Cytek Biosciences品牌商
7 年
手机商铺
- NaN
- 0
- 1
- 2
- 1
推荐产品
公司新闻/正文
单激光+AI分析,史上最简单的TBNK检测
1726 人阅读发布时间:2021-02-05 11:54
研究背景
淋巴细胞亚群(TBNK)检测是最常见的流式细胞术临床应用之一,用来帮助临床医生了解和实时监测病人的免疫状态。目前主流的检测方案以四色(4C)或六色(6C)居多,传统方法需要至少两激光以上配置的流式细胞仪才能实现。

全光谱流式细胞仪采用革新的全光谱检测和分析技术,允许在同一个检测方案中使用高度相似的荧光染料。这大大增加了单个激光上可同时使用的染料数量,使检测方案的设计变得容易。
基于Cytek全光谱流式细胞仪,Cytek技术人员开发了一个改良版的蓝激光6C TBNK 方案(以下简称6CB),仅需使用单激光(蓝)即可完成检测。检测数据同时采用DeepCyto公司开发的人工智能(AI)辅助数据分析系统进行自动分析。
研究的主要目的
1)对比蓝激光方案(6CB)与传统两激光方案(6CBR),了解6CB方案的准确度和等效性;(B代表Blue--蓝激光,BR代表Blue&Red--蓝激光和红激光)
2)对比基于云技术的AI辅助数据分析与手动分析的结果,了解AI分析的表现。
研究方法
采用Lyse-No-Wash方法,分别用光谱流式的6CB方案(CD3-FITC, CD4-PE Cy7, CD8 PE-Dazzle594, CD19 PE-Cy5, CD(16+56)-PE,及 CD45 PerCP-Cy5.5)和传统流式6CBR方案,对全血和质控血(CD-CHEX PLUS Normal 或 CD4 Low) 进行染色。在Cytek NL或Aurora全光谱流式细胞仪上进行样本获取。两个方案的详细信息如下图1。
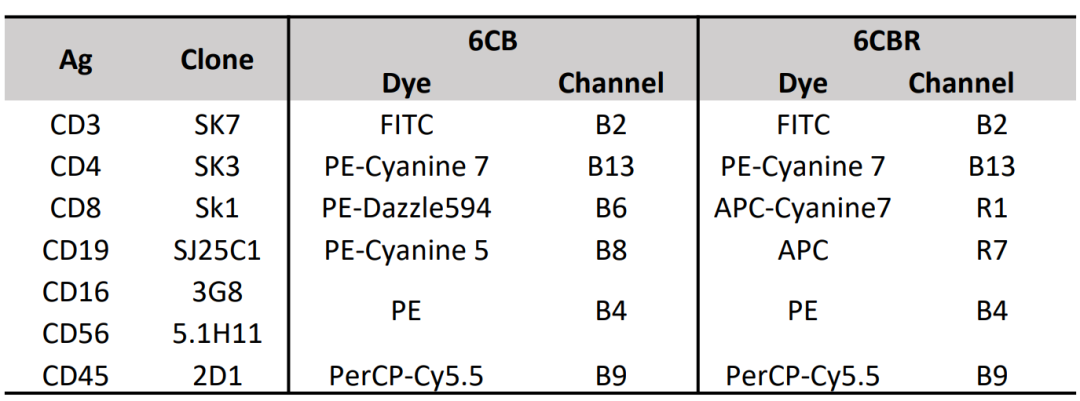
图1- 6CB和6CBR方案的详细信息
对获取的数据分别进行手动分析和AI辅助的数据分析。手动分析利用SpectroFlo软件通过顺序设门获得目标细胞亚群的百分比和绝对计数(体积计数法)。AI 分析流程,解析后的FSC文件被上载至基于云的DeepFlow平台,细胞由自动设门程序(Automatic Gating Engineering, AGE)进行聚类,然后通过结合了多种机器学习技术的自动分群器(Automatic Population Classifier, APC)对感兴趣的细胞亚群进行鉴定。AI分析流程如下图2A-2C所示。
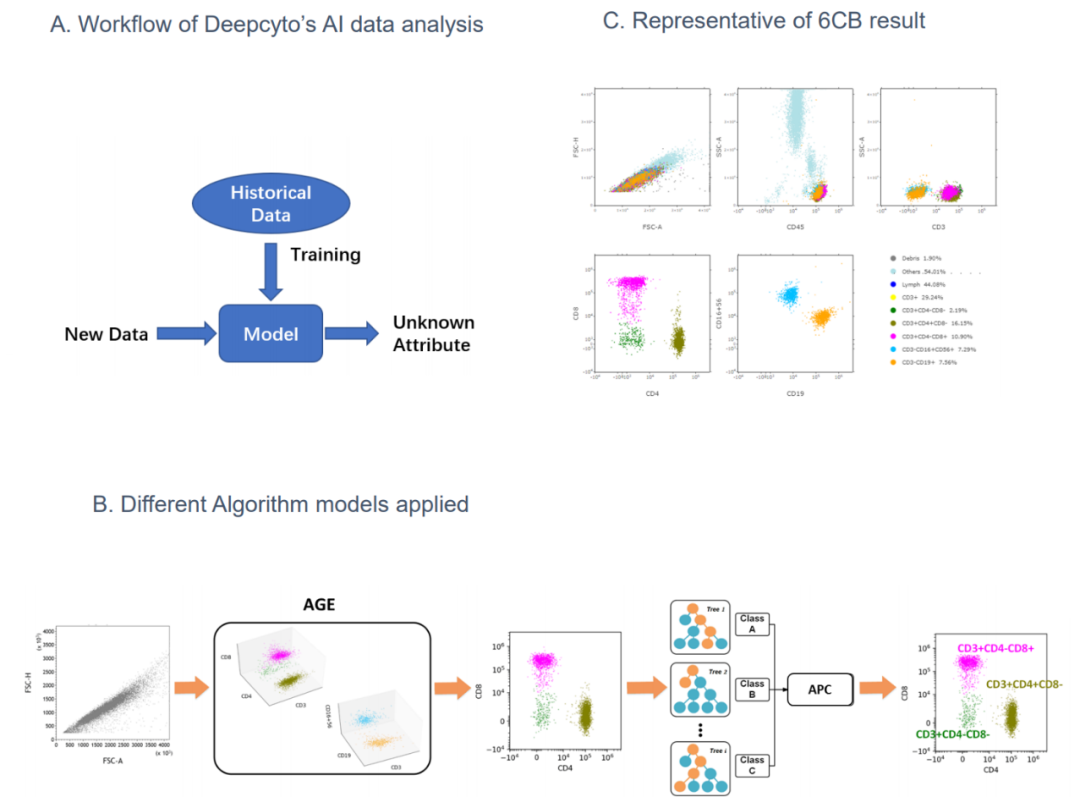
图2 – AI自动分析流程
研究结果
I. 6CB方案的准确性
通过评估质控血样本(CD-CHEX PLUS Normal 和 CD4 Low)中的CD3+, CD4+, CD8+, CD19+ 及 CD(16+56)+ 淋巴细胞亚群的百分比和绝对计数,以判断6CB方案的准确性。从表1中3次重复检测(R1-R3)的结果可以看出,用6CB方案检测出的数据值与目标靶值非常接近,证明6CB方案具有很高的准确度。
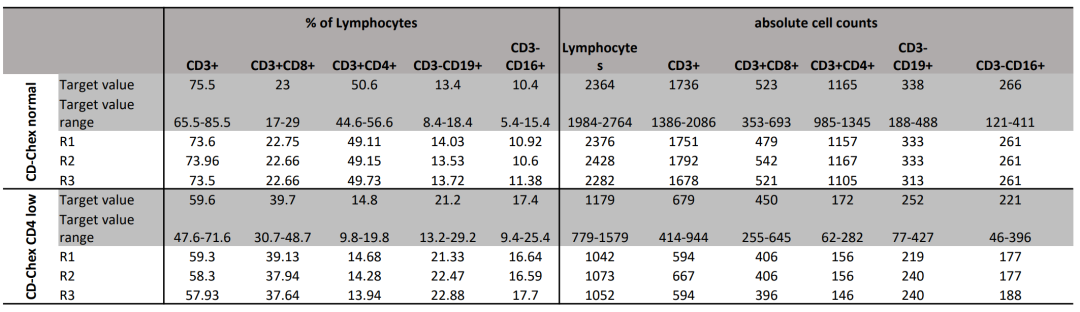
表1- 质控血中6CB方案的淋巴细胞亚群百分比与绝对计数
II. 6CB方案的灵敏度
将质控血(CD-CHEX PLUS CD4 Normal)分别按照1:1、1:2、1:4、1:8、1:16比例进行倍比稀释,以评估6CB方案的检测灵敏度。从表2中可以看出,从2倍到16倍稀释,不同细胞亚群获得的检测结果都符合预期,尤其是2倍稀释的情况,经检测而计算出的稀释倍数与实际稀释倍数非常接近。详细结果可参考表2,其中DL1-DL5代表的即是不同的稀释倍数。
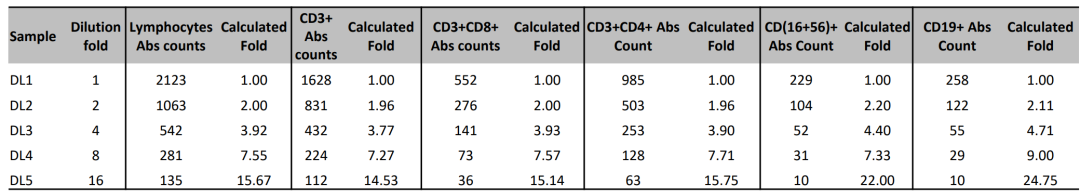
表2- 不同稀释比例的质控血的6CB方案检测结果
III. 6CB方案与6CBR方案的一致性
为了解单激光6CB方案和两激光6CBR方案是否具有一致的表现,研究人员对150例全血样本用两种方案分别进行染色,并对结果进行比较(图3)。
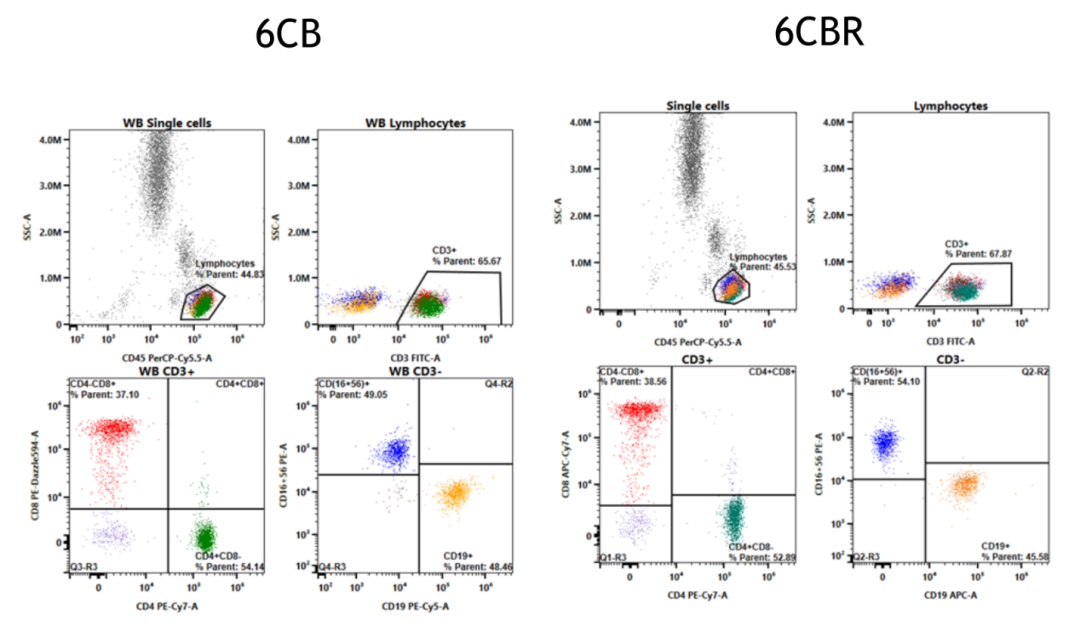
图3- 6CB方案和6CBR方案具有一致的结果
采用Pearson相关系数和线性回归分析评估各淋巴细胞群百分比和绝对计数之间的相关性, 150例全血样本的6CB和6CBR检测结果显示,所有细胞群的百分比和绝对计数的平均值和范围是相似的,Pearson相关系数(r2 >0.94)和线性回归均表现出极好的相关性(图4)。
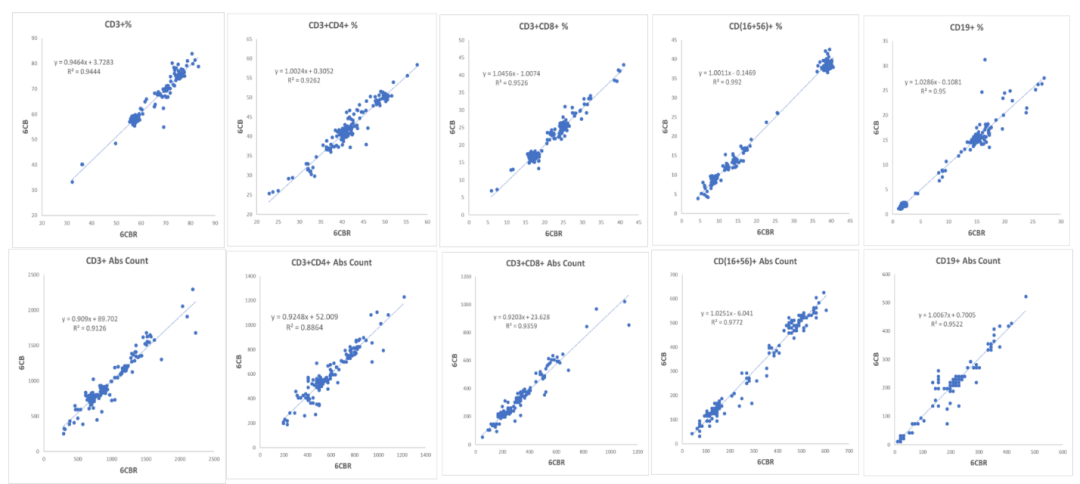
图4- 线性回归显示6CB方案和6CBR方案有极好的相关性
IV. 手动分析与AI分析的一致性
为了评估Deepcyto AI辅助分析平台的性能,分别采用手动分析流程(SpectroFlo)和AI分析平台对145份6CB染色的全血样本进行分析。使用Pearson相关系数和线性回归分析评估两种分析方法各淋巴细胞群体的百分比和绝对计数之间的相关性,结果显示两种分析方法表现出高度的相关性(r2 > 0.95) (图5)。
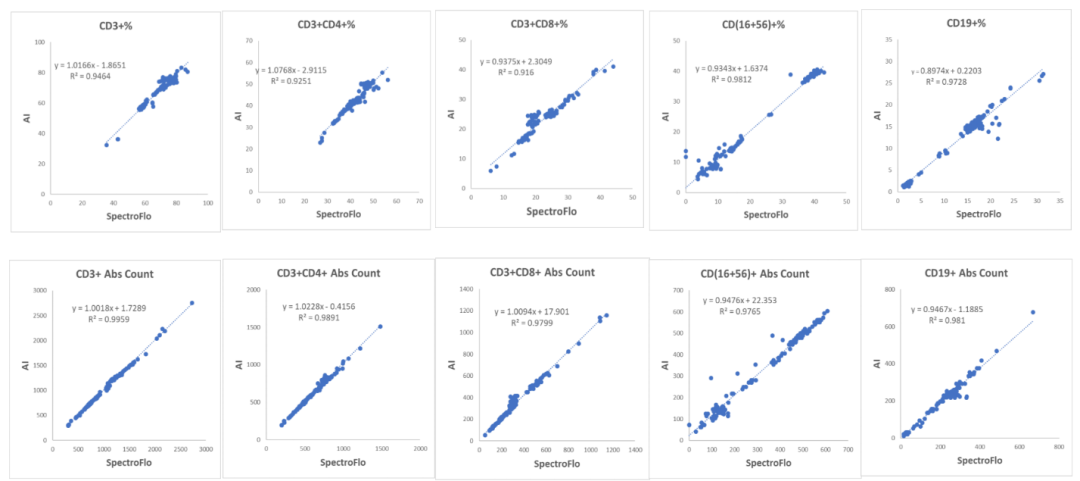
图5- 线性回归显示手动分析与AI分析结果有极好的相关性
结 论
通过上述研究证实,改良后的6CB(蓝激光6色淋巴细胞亚群)方案与AI分析工具结合,可实现快速且精准的T、B和NK细胞亚群分析。Cytek光谱流式细胞仪结合AI分析平台,将为临床带来高性价比的的免疫分型解决方案。
作者及参考文献
Jennifer Liu1, Huanyu He2, Jun Deng1, Zhigang Wang2 .
1. 46107 Landing Pkwy, Cytek Biosciences, Inc., Fremont, CA, United States,
2. R&D, DeepCyto L.L.C., West Linn, OR, United States, 3R&D, Cytek Biosciences, Fremont, CA, United States
参考文献:
• Jackson A. Basic phenotyping of lymphocytes: selection and testing of reagents and interpretation of data. Clin Immunol Newslett. 1990;10:43-55.
• Giorgi JV. Lymphocyte subset measurements: significance in clinical medicine. In: Rose NR, Friedman H, Fahey JL, eds. Manual of Clinical Laboratory Immunology. 3rd ed. Washington, DC: American Society for Microbiology; 1986:236-246.
• Farmer JR, DeLelys M. Flow Cytometry as a Diagnostic Tool in Primary and Secondary Immune Deficiencies. Clin Lab Med. 2019 Dec;39(4):591-607.
• Ferrer-Font L, Pellefigues C, Mayer J, Small S, Jaimes M, Price K. Panel Design and Optimization for High-Dimensional Immunophenotyping Assays Using Spectral Flow Cytometry. Cytometry A. 2020 May 25.
• Li Y, Mahjoubfar A, Chen CL, Niazi KR, Pei L, Jalali B. Deep Cytometry: Deep learning with Real-time Inference in Cell Sorting and Flow Cytometry. Sci Rep. 2019 Jul 31;9(1):11088.






