Cytek Biosciences品牌商
7 年
手机商铺
- NaN
- 0
- 1
- 2
- 1
推荐产品
公司新闻/正文
硬核流式操作指南:合理设置对照样本区分阳性群体
4570 人阅读发布时间:2022-04-11 12:35
流式多色分析中,抗体不良结合、染料间的荧光溢漏以及样本自发荧光等多种因素可导致非标记细胞的背景信号提升,为阳性细胞类群的准确圈门带来诸多挑战。合理使用对照样本可以帮助流式操作者更深入地评估不同来源背景信号对流式检测的影响,在辅助圈门的同时为实验方案改善提供指导。常见的对照包括同型对照(Isotype Control)、荧光减一对照(FMO Control)、生物学对照(Biological Comparison Control)等。本期文章将和大家讨论各类型对照设置的目的与局限性,硬核流式操作指南,给你有据可查的流式操作技巧。
同型对照(Isotype Control)
同型对照是使用与目标荧光抗体同种类型(包括相同种属来源、亚型、剂量、荧光标记及相同免疫球蛋白)的荧光一抗染色对照样本,研究人员希望通过同型对照评估抗体不良结合对背景信号的干扰1。
近十几年来,人们在同型对照的使用中充满争议,认为同型对照对于辅助圈门不具指导意义。充分理解荧光抗体不良结合的机制将有助于揭示同型对照的局限性。图1总结了抗体不良结合的多种类型,其中包括抗体对非目标抗原表位的低亲和非特异结合(图1.A-C);染料分子对抗原的非特异性吸附(图1. D-F)以及抗体与非目标抗原表位的特异性结合(图1. G-I),如Fc受体(CD16、CD32、CD64及CD89)对抗体Fc端的结合(图1.H)。
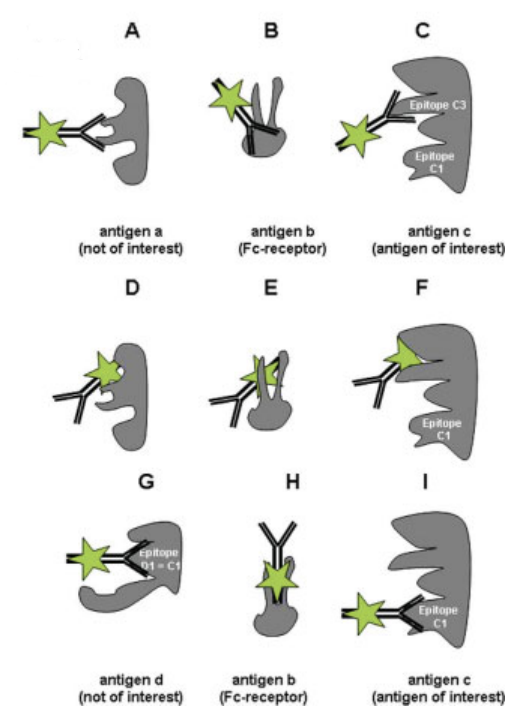
图1. 抗体不良结合包含多种类型,
仅靠同型对照无法覆盖全部
显然,同型对照无法覆盖所有抗体不良结合所带来的影响,但可在一定程度反映抗体非特异吸附与Fc端特异性结合的程度。此外,同型对照对于同型抗体的要求又是极为苛刻的,不同生产工艺下染料/抗体比例的不同会带来抗体非特异结合的差异,不同免疫球蛋白也可导致同型对照染色背景的显著区别(图2)。选择与目标抗体同厂家的同型抗体可以减少生产工艺带来的系统误差。
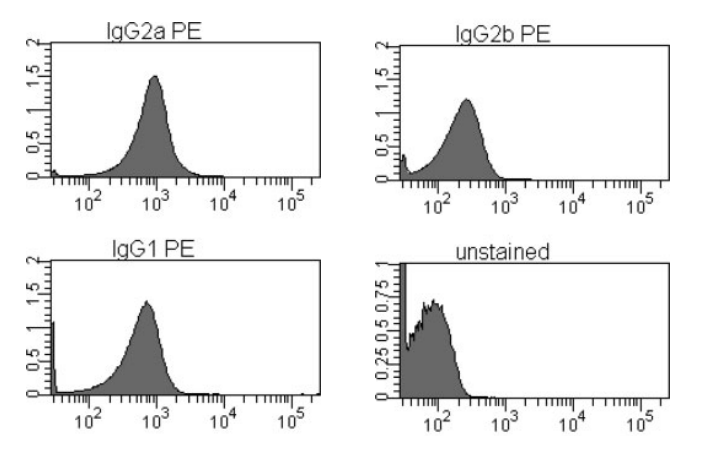
图2. 不同种类的同型抗体可带来差异化背景信号
由于理想的同型抗体难以获得以及方法学限制因素,领域内科学家对于同型对照所达成的共识是,同型对照无法单独作为多色实验中的圈门依据,仅在某些特殊环境下(如新采购抗体的特异性评估评等)可用于定性分析。1,2,3对于非特异吸附与Fc端结合所带来的背景信号提升,更好的解决方案是通过抗体滴定及Fc Block等降低影响。
荧光减一对照(FMO Control)
荧光减一(Fluorescence Minus One, FMO)对照是指多色实验中仅不染色目标荧光抗体的对照样本,常用于评估多色方案中目标通道受其余染料的荧光溢漏干扰。文献中普遍认为在高维流式分析中,相比于抗体非特异吸附,背景信号主要来自于荧光溢漏所产生的扩散误差(Spread Error),因此相比于同型对照,FMO对照被认为是多色实验中更重要的门控对照。4,5
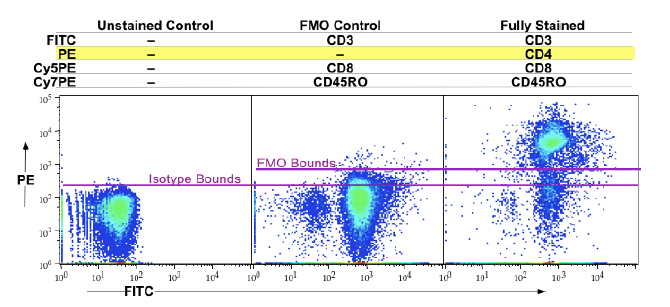
图3. 高维流式分析中,
更推荐使用FMO对照辅助圈门
同时,在多色流式中,FMO对照也常用于判定方案中相似染料的相互影响。如在OMIP-69全光谱流式40色染色方案中,研究人员使用FMO对照确认了FITC与BB515两种光谱相似染料在同一染色方案中共用的可行性(图4)。6
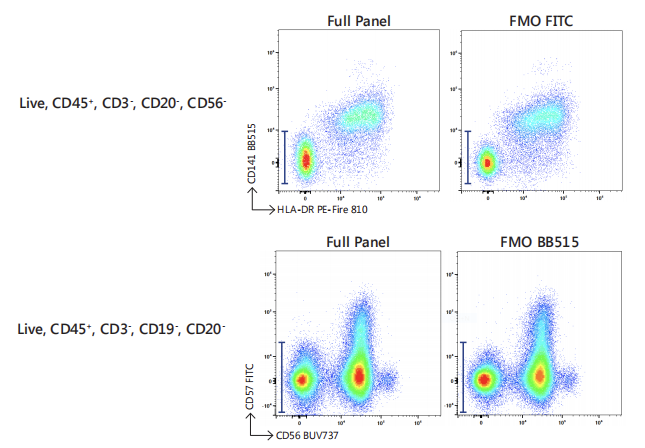
图4. 使用FMO对照评估光谱相似染料干扰情况
对于超过20色的染色方案,出于对样本总量和实验经济性的考量,有文献报道可将FMO对照扩展为Fluorescence Minus Multiple(FMM)提高实验效率。图5所示的25色全光谱流式分析方案中,研究人员仅通过3组FMM便完成了19中荧光抗体的对照设置。7
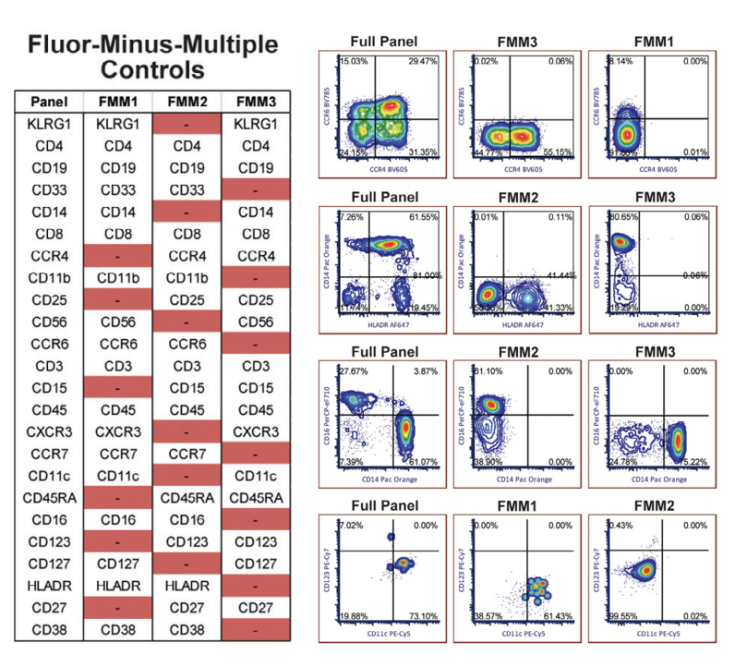
图5. 将FMO扩展为FMM可提高实验效率
除荧光溢漏评估外,FMO对照也被报道用于染色流程的优化。例如一项关于趋化因子受体染色方案优化的研究中,研究人员巧妙地利用FMO对照发现一次性加入CCR5、CX3CR1、CCR2抗体可导致空间位阻效应引起的染色不足,FMO-CCR5染色组的CCR2染色效率大幅提升,从而为分批次染色的流程的优化提供了理论基础。8
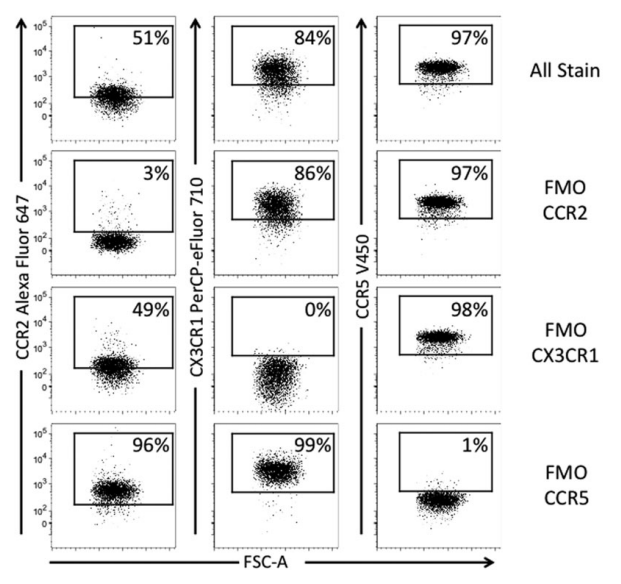
图6. FMO对照可用于染色流程优化
生物学对照
(Biological Comparison Control)
生物学对照对于特定标志物的准确圈门具有极其重要的价值。例如在细胞刺激实验中,未刺激对照样本包含了所有荧光抗体可提供FMO和同型对照所包含的荧光溢漏、非特异性吸附信息,与实验组的区别仅为样本刺激。因此未刺激对照可作为理想的阴性群体辅助圈门。在非刺激实验中,依然需要通过生物学对照对实验现象进行合理解释,例如任何疾病状态与健康个体之间的表性对比,其重要性不言而喻。
总 结
包括流式在内的任何分析实验中,对照样本对于实验结论的合理解释都是至关重要的。本期流式硬核操作指南通过综述多篇经典研究论文,探讨了流式分析中常见对照设置的目的与局限性,以及目前领域内对于几种对照样本的主流观点。欢迎大家阅读参考文献原文,获取更详细流式对照硬核信息。
往期硬核流式操作指南
>>> 荧光补偿,怎样调更可靠?
>>> 抗体滴定,看似繁琐但很必要
参考文献:
1.Hulspas R, O'Gorman MR, Wood BL, Gratama JW, Sutherland DR. Considerations for the control of background fluorescence in clinical flow cytometry. Cytometry B Clin Cytom. 2009. doi: 10.1002/cyto.b.20485.
2.O'Gorman M , Mcnally A C , Anderson D C , et al. A Rapid Whole Blood Lysis Technique for the Diagnosis of Moderate or Severe Leukocyte Adhesion Deficiency. Ann N Y Acad. 2010. doi: 10.1111/j.1749-6632.1993.tb38807.x
3.Hammerbeck C, Goetz C, Bonnevier J . Primary and Secondary Antibodies and Flow Cytometry Controls. 2018.
4.Staats J, Divekar A, Mccoy J P, et al. Guidelines for Gating Flow Cytometry Data for Immunological Assays. 2019.
5.Maecker HT, Trotter J. Flow cytometry controls, instrument setup, and the determination of positivity. Cytometry A. 2006. doi: 10.1002/cyto.a.20333
6.Park LM, Lannigan J, Jaimes MC. OMIP-069: Forty-Color Full Spectrum Flow Cytometry Panel for Deep Immunophenotyping of Major Cell Subsets in Human Peripheral Blood. Cytometry A. 2020. doi: 10.1002/cyto.a.24213.
7.Jensen H A, Wnek R. Analytical performance of a 25‐marker spectral cytometry immune monitoring assay in peripheral blood. Cytometry Part A.2020. doi: 10.1002/cyto.a.24290
8.Jalbert E, Shikuma CM, Ndhlovu LC, Barbour JD. Sequential staining improves detection of CCR2 and CX3CR1 on monocytes when simultaneously evaluating CCR5 by multicolor flow cytometry. Cytometry A. 2013. doi: 10.1002/cyto.a.22257
关于Cytek
Cytek®️ Biosciences, Inc.(Nasdaq: CTKB)作为一家全球技术生命科学技术公司,通过其受专利保护(US10739245B2)的全光谱分析(Full Spectrum Profiling,FSP™)技术,提供高分辨率、高参数和高灵敏度的新一代细胞分析工具。Cytek的创新技术通过检测荧光信号的完整光谱信息,以实现更高水平更高灵敏度的多参数检测。Cytek的FSP™平台包括其核心仪器—Aurora和Northern Lights™分析系统、Aurora CS分选系统、试剂、软件和服务,为客户提供全面和完整的解决方案。Cytek总部位于美国加利福尼亚州Fremont,在全球设有分部和分销渠道。
更多的相关信息,请登录Cytek的官方网站:www.cytekbio.com和www.cytekbio.com.cn。
注:Cytek®️, Tonbo Biosciences, cFluor®️, Full Spectrum Profiling™, FSP™和Northern Lights™是Cytek Biosciences, Inc. 的商标或注册商标。






