Cytek Biosciences品牌商
7 年
手机商铺
- NaN
- 0
- 1
- 2
- 1
推荐产品
公司新闻/正文
硬核流式操作指南—多种组织细胞悬液制备方案合集
4155 人阅读发布时间:2023-01-04 14:23
近年来经过技术迭代,全光谱流式技术凭借强大的相似染料分辨能力与自发荧光提取功能,已成为国际众多高水平研究机构中高频使用的免疫学检测技术。在超多色免疫分析中,除标准化的染色方案建立与上机检测优化外,选用合理的细胞悬液制备方案对于细胞在原位组织生物信息的保留具有重要意义。本期硬核流式操作指南将结合马拉汉医学研究所Ian F. Hermans团队发表于Current Protocols of Flow Cytometry中的实验方案,介绍T、NK细胞高维免疫分析中,肝脏、脾脏、肺脏及淋巴结样本的细胞悬液制备流程。硬核流式操作指南,给你有据可查的流式操作技巧。
· 小鼠肝脏样本处理流程 ·
01
颈椎脱位或CO2窒息处死小鼠并采集肝脏样本,去除胆囊及其他结缔组织;
02
立即将样本放入加有1 mL预冷的肝脏收集缓冲液(配方见文末)的24孔板中,并将孔板置于冰上。
03
将70 μm滤网放于50 mL离心管管口,使用1 mL注射器柱塞尾部在滤网中研磨肝脏样本,研磨过程中逐次加入RPMI培养基冲洗滤网,直至收集细胞悬液总体积30 mL。需注意该过程应在冰上完成。
04
离心细胞悬液(572 g,4 ℃,5 min),并轻轻吸去上清。
05
向离心管中加入30 mL 35% Percoll缓冲液(配方见文末),轻轻翻转离心管以重悬细胞(该过程不可使用涡旋),并确保细胞悬液中无明显细胞团块。
06
500 g,RT离心细胞20 min,离心机不设置刹车。
07
抽吸肝实质细胞层(上层)并去除上清,仅保留RBC/WBC。
08
向离心管中加入5 mL RBC裂解缓冲液,在21-23 ℃环境中裂红10 min。注意裂红期间需轻摇试管,裂红时间可根据裂红缓冲液的不同而调整。
09
572 g,4 ℃离心4 min,弃上清后将细胞重悬于FACS缓冲液(配方见文末)。
10
4 ℃保存细胞,或进行后续样本染色。
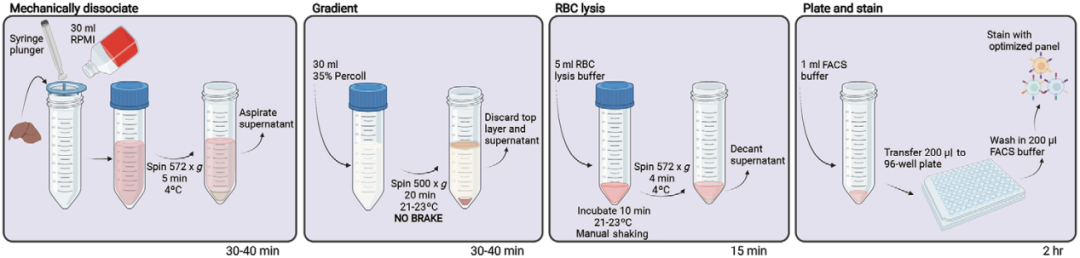
图1. 小鼠肝脏样本处理流程
· 小鼠脾脏样本处理流程 ·
01
通过颈椎脱位或CO2窒息处死小鼠并采集脾脏样本。
02
将样本放入加有1 mL预冷RPMI培养基的24孔板中,并将孔板置于冰上。
03
将70 μm滤网放于50 mL离心管管口,使用1 mL注射器柱塞头部在滤网中研磨脾脏样本,并使用20 mL RPMI培养基冲洗细胞,完成后将细胞悬液置于冰上。
04
572 g,4 ℃离心细胞悬液4 min。
05
弃上清后加入2 mL RBC裂解液重悬细胞。
06
室温下轻摇离心管1 min完成裂红,572 g,4 ℃离心细胞悬液4 min。
07
弃上清后使用1 mL FACS缓冲液重悬细胞。
08
4 ℃保存细胞,或进行后续样本染色。
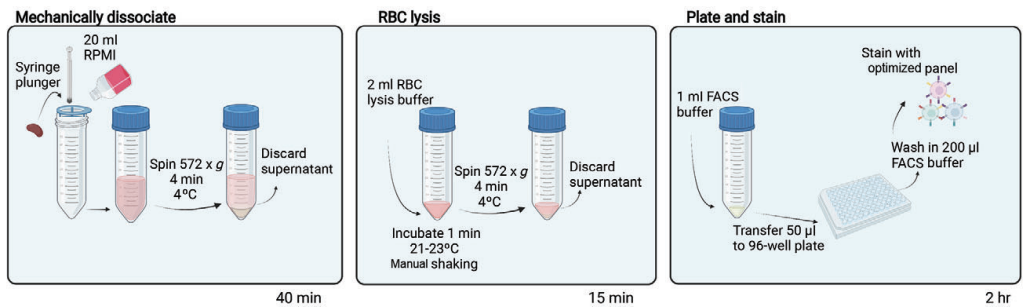
图2. 脾脏样本处理流程
· 小鼠肺脏样本处理流程 ·
01
颈制备新鲜的肺组织消化缓冲液(配方见文末)。
02
通过CO2窒息处死小鼠(注意不要使用颈椎脱位法处死小鼠),采集小鼠肺脏并去除结缔组织。
03
将样本放入加有1 mL预冷RPMI培养基的24孔板中,并将孔板置于冰上。
04
去除RPMI培养基,并将肺组织切成小块。
05
加入1 mL肺组织消化缓冲液,37 ℃孵育45 min。
06
加入50 μL 0.5 M EDTA溶液,37 ℃孵育5 min。
07
使用3 mL注射器针筒用力吹吸经消化的肺组织样本10次,使其解离。吸入样本时,可以借助注射剂针头在孔板中研磨肺组织;挤出时需将针筒压住孔板底部挤出,以充分解离样本。
08
将70 μm滤网放于50 mL离心管管口,使用1 mL注射器将孔板中解离的肺组织样本经滤网转移至离心管,并使用1 mL RPMI培养基清洗孔板。使用1 mL注射器柱塞尾部在滤网中研磨肺组织样本,逐次加入共20 mL RPMI培养基冲洗细胞。
09
572 g,4 ℃离心细胞悬液4 min。
10
弃上清后加入2 mL RBC裂解液重悬细胞。
11
在21-23 ℃环境中裂红10 min,裂红期间需轻摇试管。裂红完成后72 g,4 ℃离心细胞悬液4 min。
12
弃上清后使用1 mL FACS缓冲液重悬细胞。
13
4 ℃保存细胞,或进行后续样本染色。
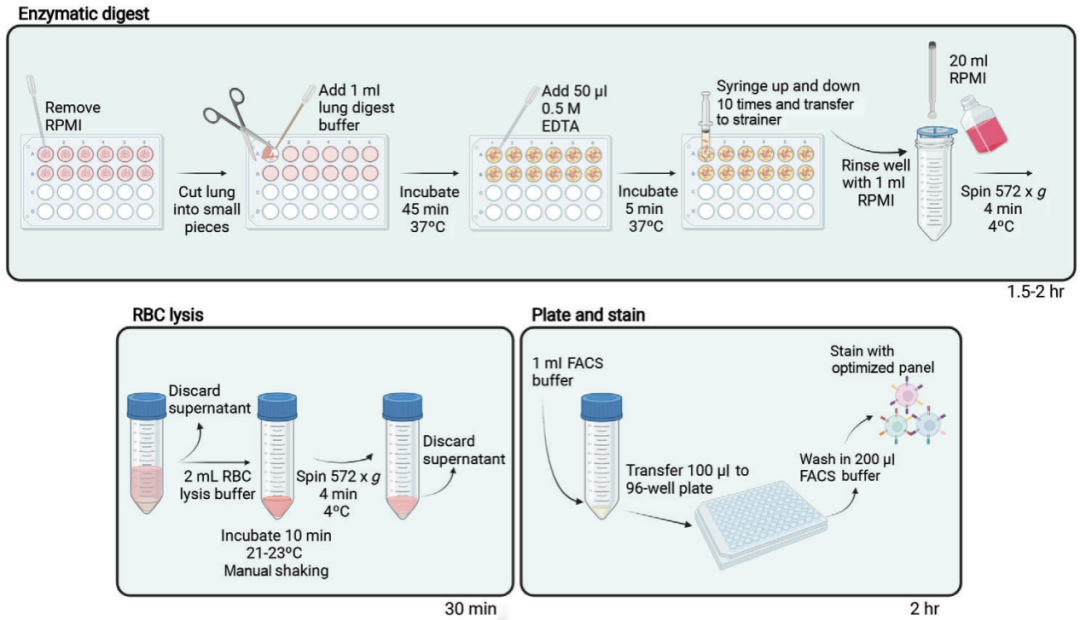
图3. 肺组织样本处理流程
· 小鼠淋巴结样本处理流程 ·
01
通过颈椎脱位或CO2窒息处死小鼠并采集淋巴结样本并去除结缔组织,如采集小鼠颈部或纵膈淋巴结则不可使用颈椎脱位处死小鼠。
02
立即将样本放入加有1 mL预冷RPMI培养基的24孔板中,并将孔板置于冰上。
03
每个小孔中放入~0.5 × 0.5 cm厚纱布,使用1 mL注射器柱塞尾部在厚纱布上解离淋巴结样本,转移样本至1.7 mL离心管。
04
1503 g,4 ℃离心细胞悬液4 min。
05
吸去上清,并使用500 μL RBC裂解液重悬细胞。
06
21-23℃裂红1 min,随后1503 g,4 ℃离心细胞悬液4 min。
07
吸去上清,使用200 μL FACS缓冲液重悬细胞,并进行后续染色。
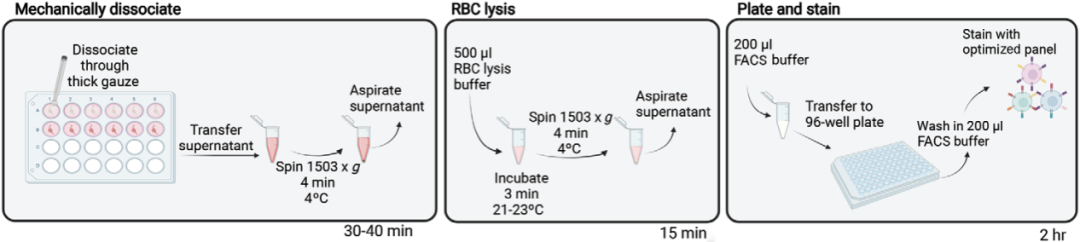
图4. 小鼠淋巴结样本处理流程
“
小鼠肝脏21色T细胞方案数据赏析
研究人员利用上述优化的细胞悬液制备流程,测试了小鼠21色T、NK细胞检测方案,用于评估一种可诱导CD8+TRM在小鼠肝脏积累的疫苗所产生的免疫应答,并使用Cytek®️ Aurora全光谱流式细胞仪进行检测。由于TRM类群为该方案的研究重点,如何真实保留TRM细胞原位信息成为样本制备流程的重要考量因素。例如21-23 ℃的的孵育温度可有效避免肝脏TRM细胞因P2RX7核糖化所造成的细胞死亡。此外,研究人员在样本染色中优先加入CD62L抗体(与Live/Dead染料同时染色),以避免P2RX7的核糖化造成CD62L脱落对染色的影响。小鼠肝脏21色光谱流式检测结果如图5所示,经样本制备优化后,每个标志物均表现出很棒的信号分辨。
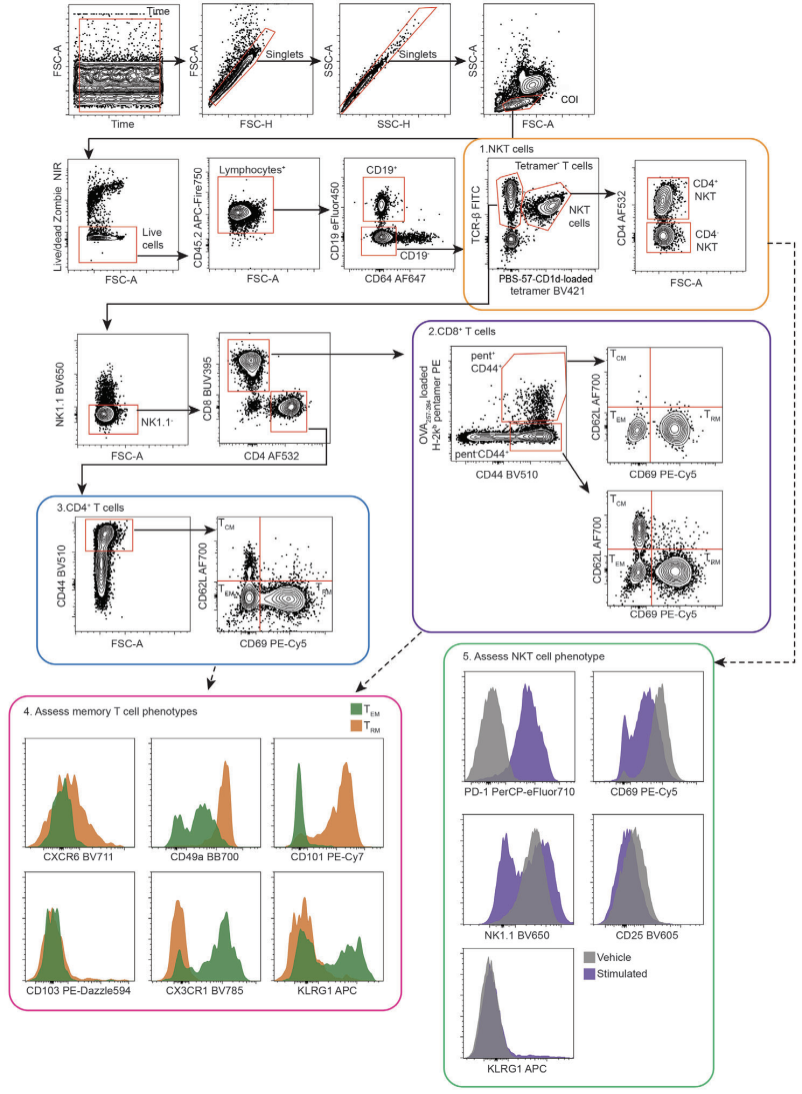
图5. 小鼠肝脏21色T、NK细胞方案数据展示
Tips:缓冲液配方
1)FACS缓冲液
1 L PBS; 1%(v/v)FBS; 2 mM EDTA; 2 mM NaN3
4 ℃冷藏可储存3个月
2.肝脏收集缓冲液(每小鼠肝脏用量)
1 mL RPMI培养基; 5% FBS;200 U/mL Heparin
4 ℃冷藏可储存2周
3.肺组织消化缓冲液(每小鼠肺脏用量)
1 mL RPMI培养基; 0.1 mg/mL Liberase TL; 0.2 mg/mL DNase I
每次实验前制备
4.Percoll缓冲液,35%(每小鼠肝脏用量)
1.9 mL 10x PBS; 10.5 mL Percoll; 17.6 mL Hank‘s buffer(无Ca2+、Mg2+、酚红); 200 U/mL Heparin
4 ℃冷藏可储存1个月
结语
本期硬核流式操作指南为大家介绍了小鼠多种组织样本前处理优化方案,尤其适用于组织驻留淋巴细胞表型分析。除恰当的样本前处理外,优化的染色方案、细胞浓度、抗体滴定、对照设置、单染制备均有助于科研人员获取高质量流式结果。更多精彩内容,欢迎参考往期推文。
往期内容回顾:
参考文献:
Farrand K, Holz L E, Ferrer‐Font L, et al. Using Full‐Spectrum Flow Cytometry to Phenotype Memory T and NKT Cell Subsets with Optimized Tissue‐Specific Preparation Protocols[J]. Current Protocols, 2022, 2(7): e482.






