Cytek Biosciences品牌商
7 年
手机商铺
- NaN
- 0
- 1
- 2
- 1
推荐产品
公司新闻/正文
Cytek®明星天团携手,揭示天然免疫细胞PMNs免疫应答
55 人阅读发布时间:2026-01-15 12:19
天然免疫就像是身体的“快速反应部队”,而多形核白细胞(Polymorphonuclear leukocytes,PMNs)则是这支队伍中的核心战斗单元,其在感染、炎症、组织损伤及修复过程中均扮演重要角色。由于PMNs的功能高度复杂,对其功能的探索既具有重要意义,同时又充满了挑战。
下述来自美国弗吉尼亚大学医学院的研究,利用了Cytek明星产品Cytek® Aurora™全光谱分析系统,Cytek® Aurora™ CS分选系统和Cytek® Amnis® ImageStream®X Mk II成像流式细胞仪,将光谱与成像技术结合,深度揭示了PMN在天然免疫应答中的作用。
研究者首先在5激光的Cytek® Aurora™全光谱分析系统上开发了22色全光谱的方案,详细分析原代人PMNs在活化、脱颗粒、吞噬、迁移、趋化等过程中的表面标志物表达情况。此外,结合Cytek® Amnis® ImageStream®X Mk II成像流式细胞仪强大的成像和统计能力,可直观呈现每个PMN的细菌吞噬量。进一步还结合了Cytek® Aurora™ CS分选系统分选出吞噬不同细菌量的PMNs,以便对不同细胞群进行深入表型分析(图1)。
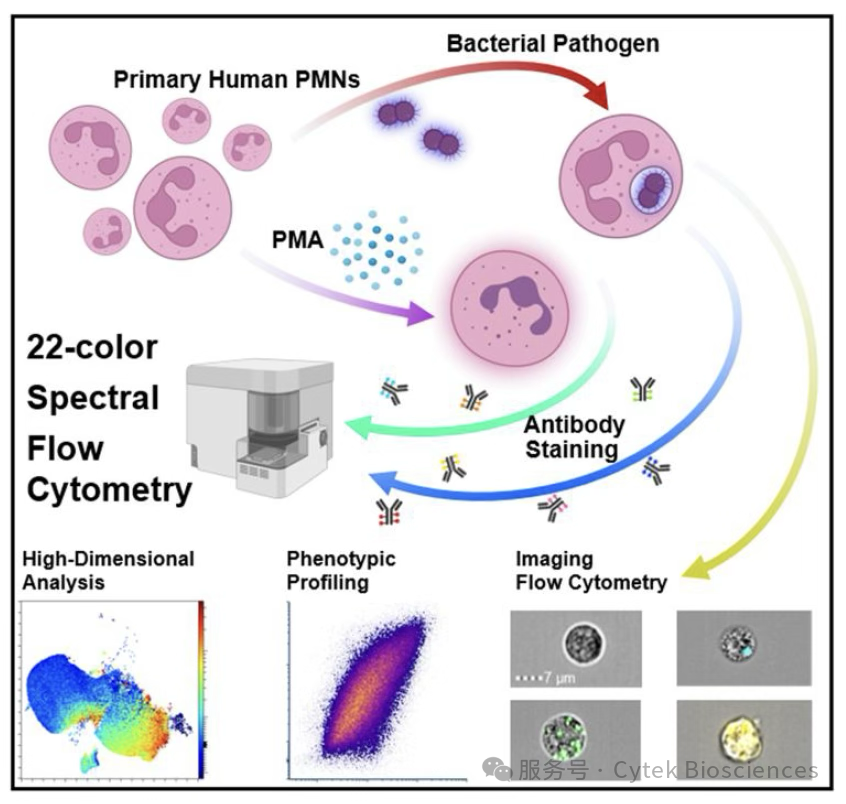
图1:研究流程简图
22色全光谱流式方案设计与圈门策略
如图2所示,研究者设计一个22色全光谱流式方案对健康人外周血中的PMNs进行分析,该方案能够以高维方式分析人PMNs,同时关注PMNs的功能和活化状态,并且在分析过程中不破坏样本,以便进行下游分选/分析,适用于该领域的多种研究问题。
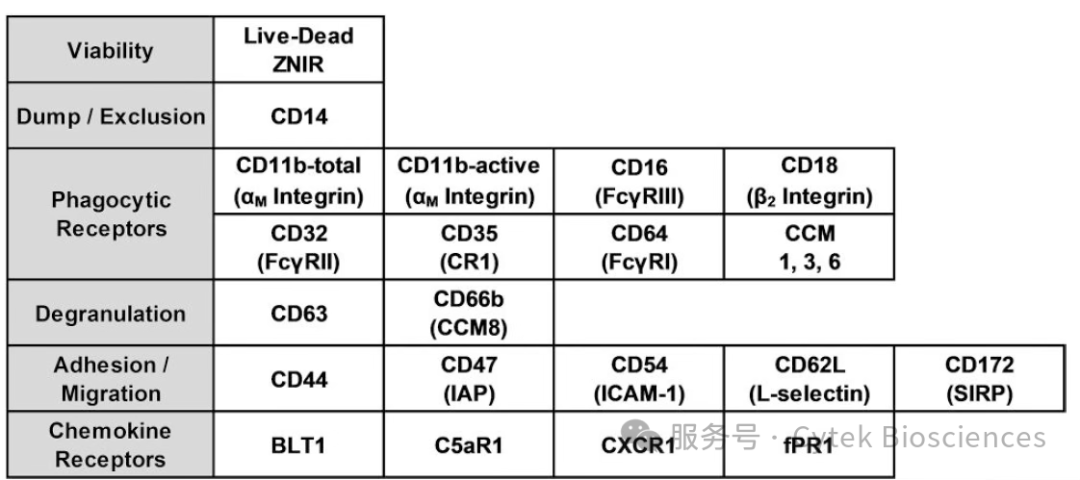
图2:检测PMNs的全光谱流式方案中的抗体组合
按照配色原则为每个抗体匹配合适的荧光染料,在后续方案中利用CellTrace Blue(BUV395通道)对淋病奈瑟菌进行标记,整体方案如图3A所示。并且在此方案中未使用FITC或AF488等这些使用频率极高的染料,便于后续的研究者扩展方案。利用Cytek®全光谱查看器(Full Spectrum Viewer)直观评估方案复杂度,图3B展示了整个22色方案的复杂度指数为9.25,而在加入AF488染料后,整个方案的复杂度未变化,展示了方案的可拓展性。
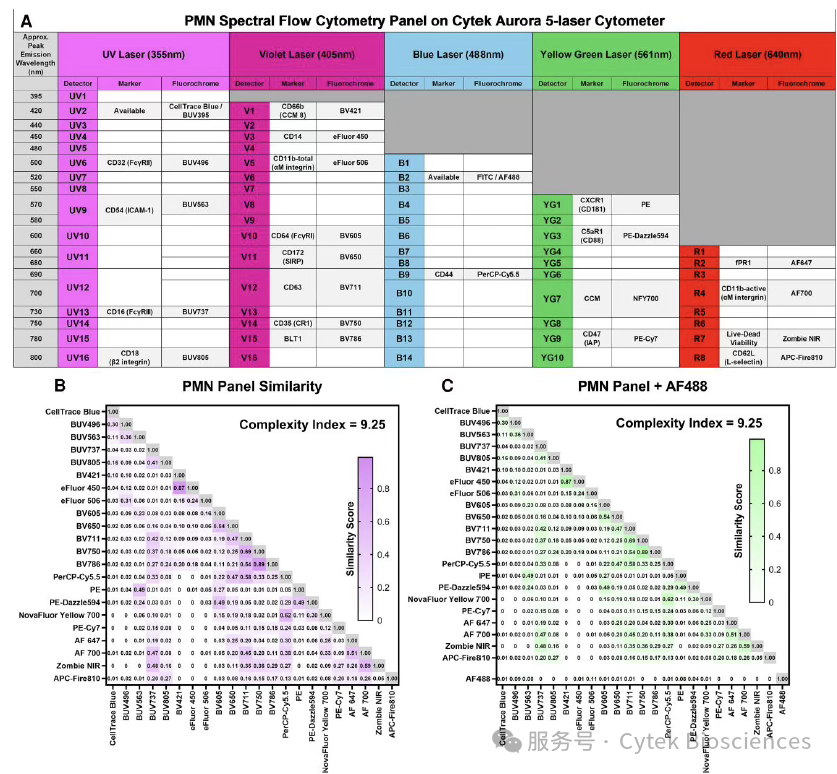
图3:在5激光Cytek® Aurora™全光谱系统上
检测PMNs的方案以及方案的复杂度的评估
在总细胞中排除死细胞和粘连体,排除CD14阳性细胞后,圈选出活的PMNs细胞(图4),以分析PMNs在抗原和病原菌刺激活化后其吞噬、脱颗粒作用、粘附或迁移以及趋化受体相关的表型。
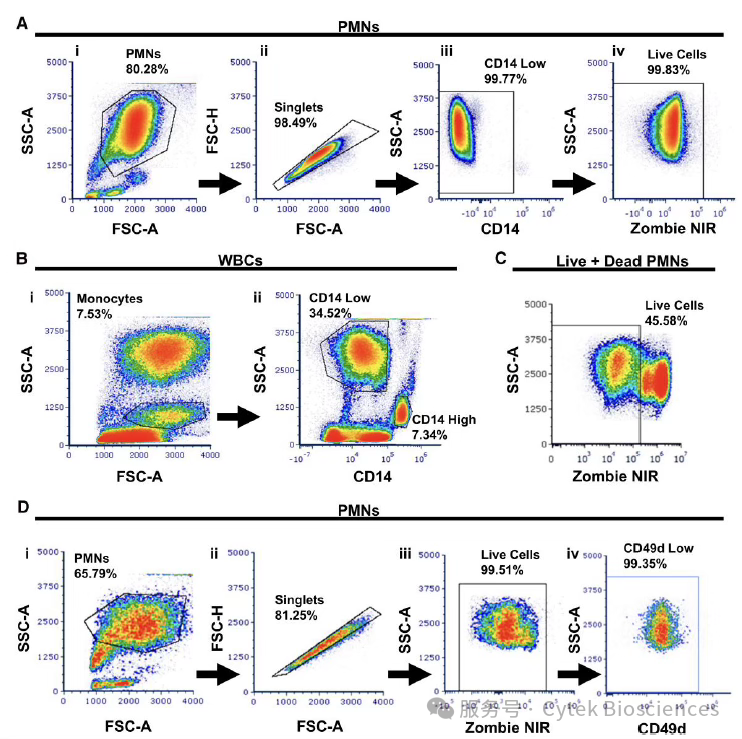
图4:单个活PMN细胞的圈门策略
佛波酯激活后的PMNs表型分析
佛波酯(PMA)是一种强效蛋白激酶C激动剂,可激活中性粒细胞。使用PMA处理PMNs后,利用Cytek® Aurora™全光谱分析系统检测发现PMA可显著改变多个表面标志物的表达。在三个不同受试者中,9种标志物表达一致上升(其中CCM、CD64、CD63、CD11b-active和fPR1具有统计学显著性,而CD32、CD18、CD47及BLT1未显著),6种标志物的表达一致下降(CD16、CD62L、CD44和C5aR1具有统计学显著性,CD35与CD172未显著),图5中利用UMAP降维分析直观展示了第三个受试者数据。全光谱流式多维分析能界定激活PMNs中的特定细胞群,为后续深入研究提供必要线索。
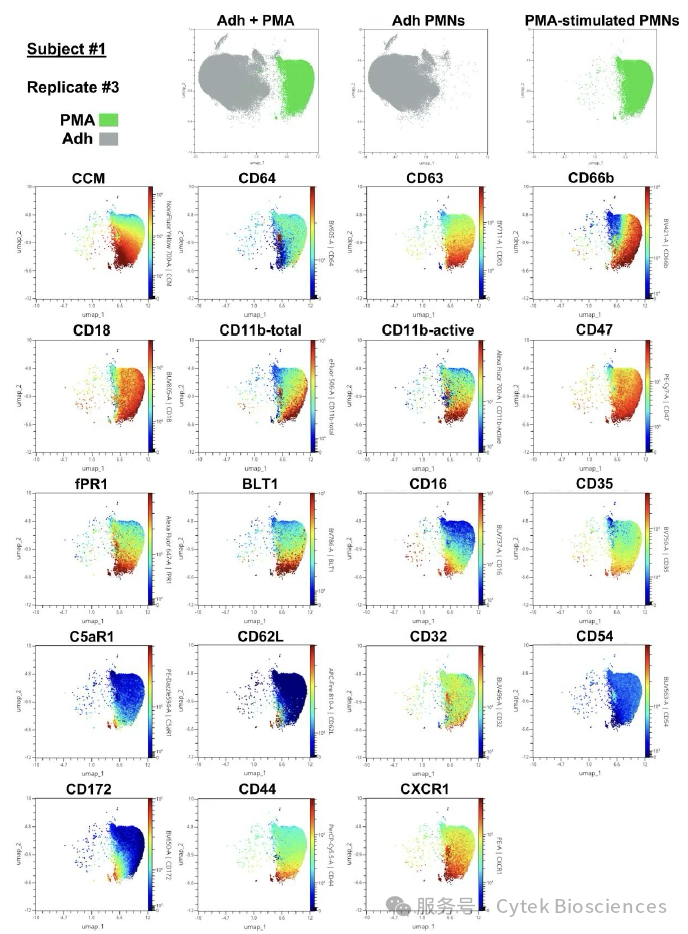
图5:UMAP展示PMA激活的PMNs的表型
解析病原菌和PMNs的相互作用
为验证22色全光谱检测方案在探究PMNs与病原体相互作用中的应用价值,研究者将CellTrace Blue标记的淋球菌和PMNs以1:1或10:1的感染复数(MOI)共培养。在Cytek® Aurora™全光谱分析系统的结果表明:8种标志物在淋球菌刺激后呈现表达量上升(CCM、CD64、CD63、CD66b、fPR1、CD18、CD11b-active及BLT1),且呈现与MOI正相关的趋势,5种标志物在感染后表达一致性下降(CD16、CD172、CD62L、C5aR1和CD44)。
此外,CellTrace Blue荧光信号评估PMNs的细菌负载量发现:MOI=1时细胞阳性率为8.2%-62.7%,而MOI=10时阳性率超过97%(图6A)。MOI=10组的MFI较MOI=1组高10倍以上,且荧光强度分布也更均匀(图6B)。
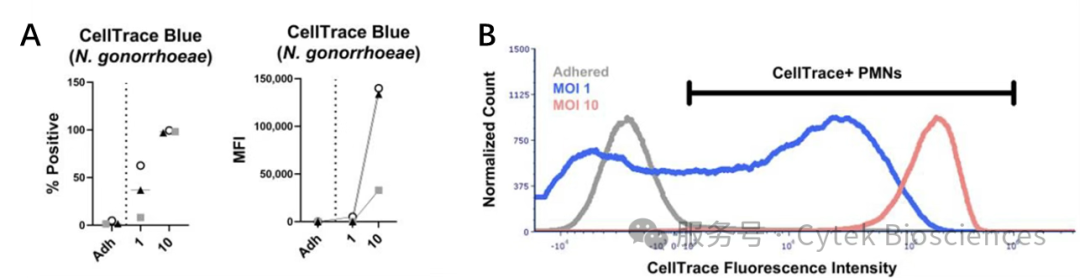
图6:A)各实验条件下PMNs的阳性率及CellTrace Blue平均荧光强度;
B)贴壁细胞组、MOI 1组与MOI 10组中CellTrace Blue荧光强度的代表性分布图。标记线标示CellTrace Blue阳性信号的设门界限。
进一步探究MOI=1处理时细胞阳性率的异质性,使用Cytek® Amnis®成像流式系统进一步分析荧光强度与细菌负载量的相关性:可根据CellTrace MFI将处理后的细胞分为无淋球菌、低细菌负载和高细菌负载群体(图7A),发现高细菌负载群体MFI是低细菌负载的19.2倍(图7B)。成像流式分析结果还显示CellTrace强度与PMNs结合细菌数量正相关,使用Cytek® Amnis®系统强大的点计数功能,可以对PMNs细胞内吞噬的细菌进行直观的成像和计数,发现高负载群体通常携带10个以上的细菌(图7C)。
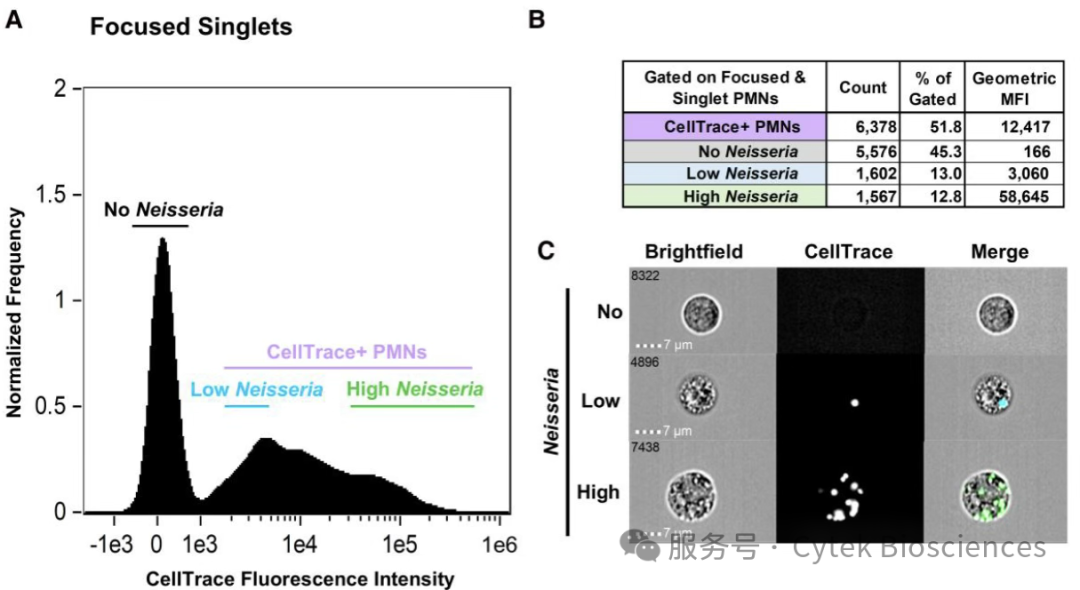
图7:使用Cytek® Amnis®成像流式系统
分析每个PMN中细菌的负载情况
全光谱分选和分析系统
联手检测不同细菌负载量的PMNs
进一步,使用Cytek® Aurora™ CS全光谱分选系统分选出MOI=1条件处理后的无淋球菌、低细菌负载和高细菌负载的PMNs群体,随后在Cytek® Aurora™全光谱分析系统上对这三群细胞进行进一步的分析。结果如图9C所示,CCM、CD64、CD63、CD11b-active和fPR1的表达量随细菌负载量增加而升高。即使是未吞噬淋球菌的细胞,其CCM、CD64和CD63表达也高于未感染对照组。
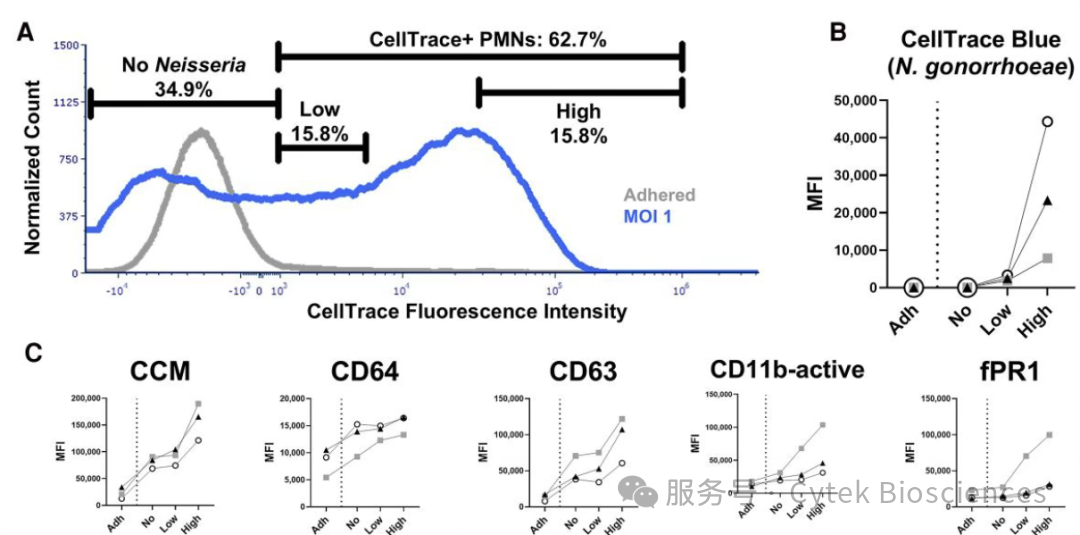
图9:细菌暴露水平与负载量的对PMNs表面标志物的表达模式影响
小
结
本研究中,研究者开发和验证了适用于人的PMNs的22色高维光谱流式细胞术检测的方案,结合5激光Cytek® Aurora™全光谱分析系统检测PMNs的活化状态,经研究证实该22色光谱方案具有广泛的适配性,并且还可根据不同研究者的实验目的进行方案的扩充。此外,利用Cytek® Amnis®成像流式细胞仪和Cytek® Aurora™ CS全光谱分选系统,可针对性的分析PMNs吞噬细菌后的不同群体的异质性,进一步拓展PMNs检测的应用深度和广度。
参考文献:
Lamb ER, et al. High-dimensional spectral flow cytometry of activation and phagocytosis by peripheral human polymorphonuclear leukocytes. Journal of Leukocyte Biology. 2025






