Cytek Biosciences品牌商
7 年
手机商铺
- NaN
- 0
- 1
- 2
- 1
推荐产品
公司新闻/正文
硬核流式操作指南:荧光补偿,怎样调更可靠?
8223 人阅读发布时间:2022-02-14 10:22
荧光补偿调节是流式用户从简单应用到多色分析实验中难以绕开的操作流程,补偿的正确调节与否直接影响实验结果的真实性。由于实验体系的多样性,针对不同的染料与标记物,荧光补偿的设置方式各有差异,个性化的调节方式为实验操作者带来很大的困扰。这篇文章将结合多篇经典流式方法学研究论文,对荧光补偿中的单染对照设置、阴阳性的圈门、补偿异常的原因等常见问题进行探讨。硬核流式操作指南,给你有据可查的流式使用技巧。
1. 荧光溢漏、补偿和光谱解析
使用流式检测多色染色样本时,受到染料较宽发射光谱的影响,染料除在主通道(如FITC在蓝激光第一通道)产生信号外,还会对相邻(FITC对PE)或间隔(PE-Cy5对APC)的其他通道产生干扰,这种现象叫做荧光溢漏。传统流式中需通过单染对照计算染料在各通道的溢漏比例,并进行扣除(荧光补偿),得到真实的实验结果。与传统荧光补偿不同,新一代的全光谱流式可通过更先进的光谱解析算法,直接提取样本中各荧光组分信号强度。1但无论是荧光补偿或是光谱解析,均需通过高质量的单染对照向仪器输入各染料准确的光谱信息。
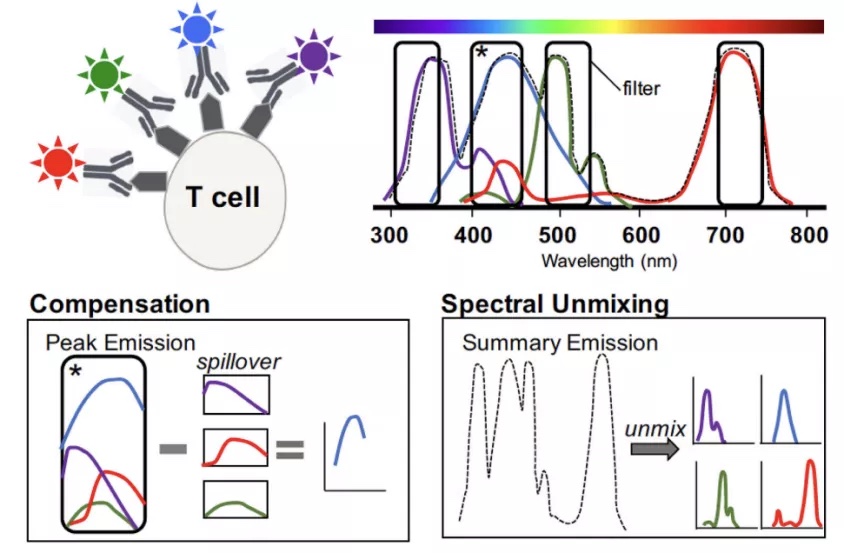
图1. 传统荧光补偿与光谱解析原理
2. 微球还是细胞,单染对照该如何设置?
高质量单染对照(足够多的细胞数目,较高的亮度,准确的光谱信息)是精准补偿/光谱解析的关键,三种常用单染管的制备方式分别包括:1. 使用与复染管中相同的细胞样本与荧光抗体制备(最常用且可靠);2. 对于染色低表达Marker或低丰度细胞的荧光抗体,使用同种颜色的不同Maarker(如FL-CD4)进行单染管制备;3. 使用补偿微球与复染管中相同的荧光抗体制备。
显然在第一种方式中,单染对照可提供与与复染样本对应荧光染料相同的光谱信息。但在第一种方式难以实现(Marker表达量过低,染色细胞丰度过低)的情况下,我们需要合理的利用第二、三种方式制备单染对照完成补偿。例如对于第二种方式,尤其是在制备串联染料(如PE-Cy5)单染对照时,来自不同公司或不同批次的PE-Cy5可能有不同的光谱表现,在这种情况下便会产生不准确的补偿,但对于单体染料(如FITC、PE等)往往不存在以上问题。补偿微球为单染对照的制备提供了更方便地解决方案,仅需向微球悬液中加入对应荧光抗体并简单清洗即可完成制备,且无染料批次问题影响。然而对于一些特定的染料(如BUV496、BUV563、BUV661、BUV805、BV480、BV570、Spark Blue 550、PE-Cy5,等),染料分子会受到微球材质的影响产生光谱变化,与复染样本不一致的光谱信息导致补偿的过度与不足。2因此,对于复杂的超多色实验,需同时结合多种单染管制备方案,并使用最合适的单染对照进行解析。得益于全光谱流式的光谱表征性能,科研人员可以轻松观察到同种染料在不同类型单染对照中的光谱差异,从而揭示光谱解析误差的来源(图2)。
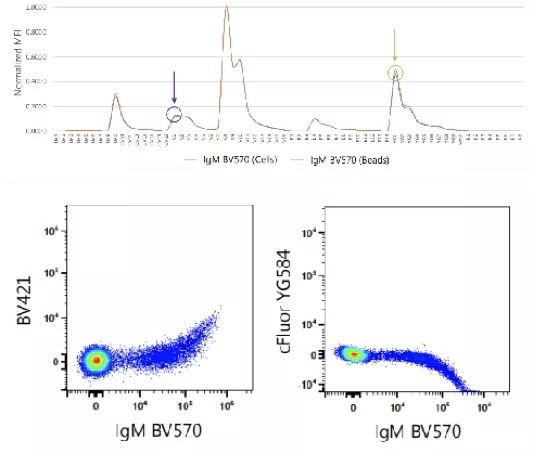
图2. 补偿微球引起BV570光谱变化,导致微球补偿不准确
3. 阴性与阳性门的圈定
单染对照的制备完成后,我们来到补偿/光谱解析中另一个需要注意的环节,自动补偿中阴性与阳性门的圈定。圈门的原则非常简单,即选定一群纯净的阳性/阴性信号,而无需选定所有的阳性/阴性。图3显示了不同阳性圈门对于补偿的影响,该实验中,仅圈定最强半个阳性峰的圈门方式得到了更好的补偿结果。3
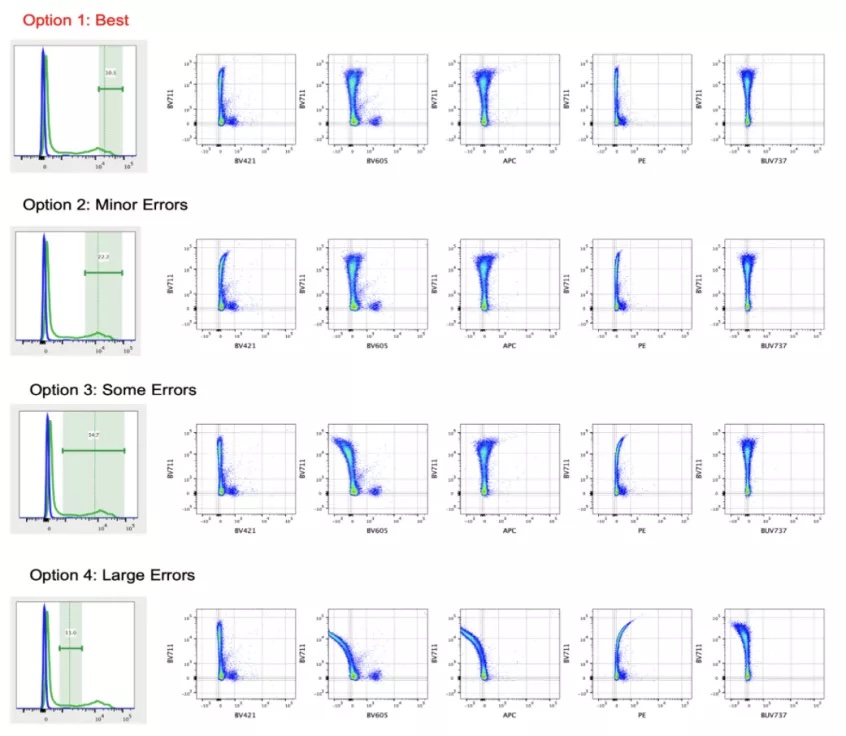
图3. 不同的阳性圈门对补偿/光谱解析的影响
Amy Fox等人的研究论文还报道的使用微球调节荧光补偿出现多个阳性峰的案例(图4)。4如使用光谱流式,可依次查看每一群信号的光谱信息,并圈定光谱信息正确的阳性群体。例如图4中APC-Fire750单染对照中强阳性峰光谱信息正确,弱阳性峰表现出APC的光谱特征。因此,图4.A的阳性圈门方式将得到正确的补偿/解析结果。
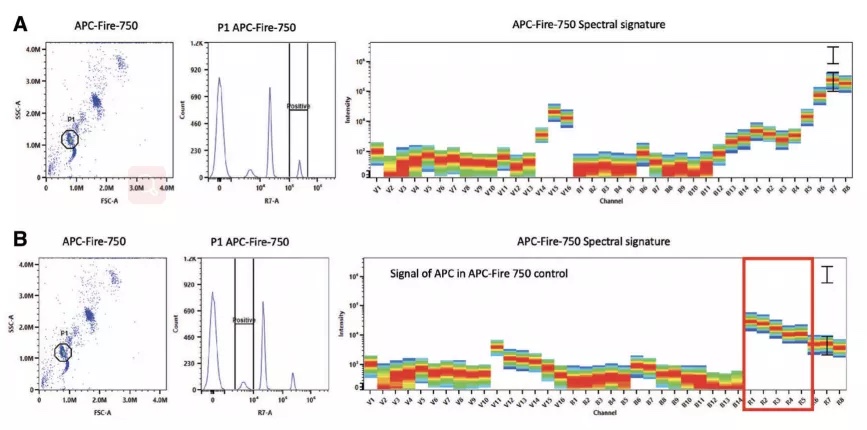
图4. 查看单染对照各类群光谱信息辅助准确圈门
此外,我们还可以通过该方法检查阴性峰的光谱信息,尤其是当阴性峰信号过高时,需判断过高的阴性信号是否来自于样本对染料的非特异性吸附(图5.B)。当这种情况出现时,可单独制备同类型(细胞/微球)的未然色对照用于阴性峰识别。
通过以上几个案例我们不难看出,全光谱流式可帮助用户在圈门过程中进一步核实单染对照的阳性/阴性各类群光谱信息,及时发现存在问题的单染对照,从而得到更精准的光谱解析结果。
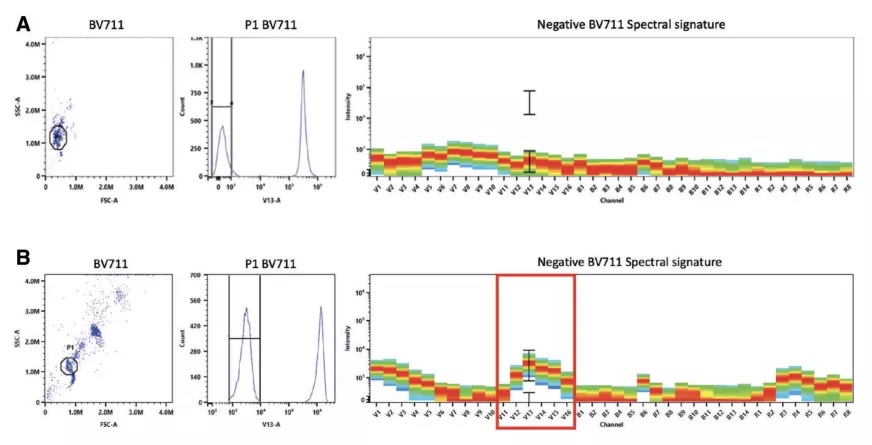
图5. 阴性圈门需注意排除非特异吸附干扰
4. 验证与手动调节
采集高质量的单染数据并完成圈门后,软件可自动计算补偿/光谱解析。对于超多色分析,对于补偿/光谱解析的进一步检查是必不可少的。可通过N*N Plot依次检查单染和复染样本的补偿/光谱解析状态2,观察每个散点图中的单阳群体是否“横平竖直”,如有轻微的补偿/光谱解析误差,并借助手动补偿调节功能进一步调整。需注意的是,目前领域内公认自动补偿的结果是更准确的,手动补偿调节仅起辅助作用。
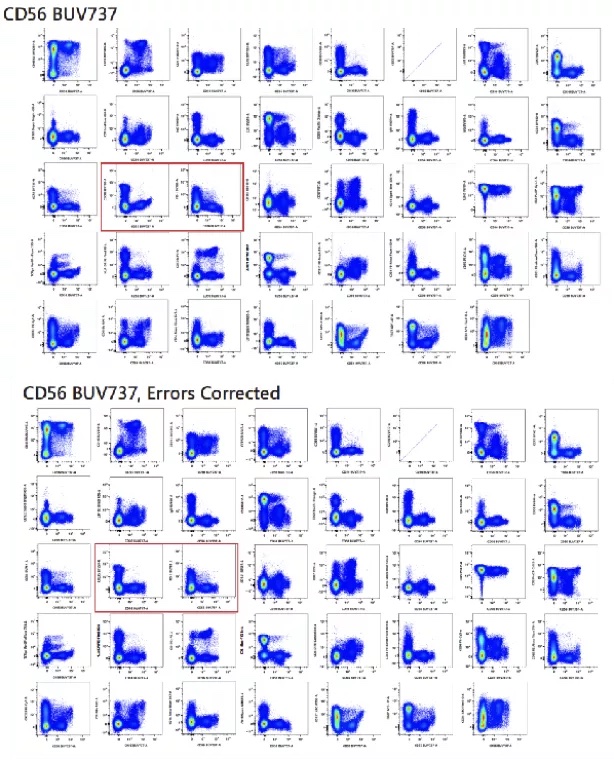
图6. 在复染样本的N*N Plot中检查补偿,
并手动调节
5. 荧光溢漏对多色实验的影响
但对于流式细胞术而言,荧光溢漏带来的不仅是在实验中增加补偿/光谱解析的操作流程,更重要的是补偿/光谱解析过程带来的背景信号展宽影响对应通道的检测灵敏度与分辨率。5相比于传统流式解线性方程组的荧光补偿方式,光谱流式更先进的光谱解析算法可进一步降低荧光溢漏带来的信号展宽,在超多色实验中提供高品质数据。
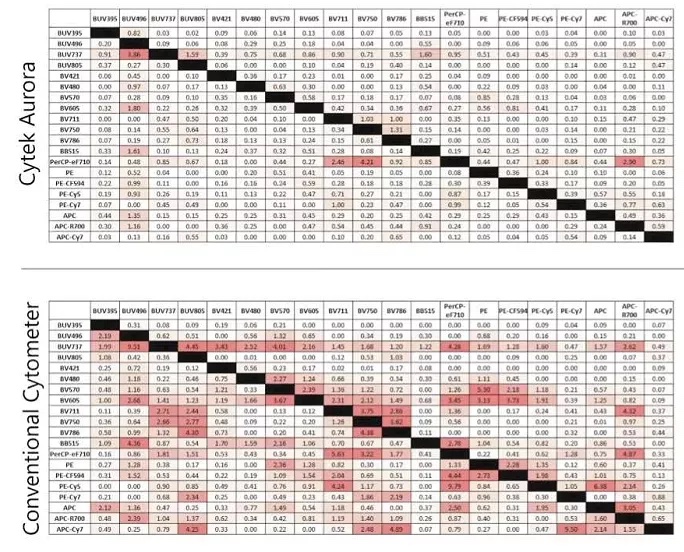
图7. 光谱流式与传统流式染料串扰(SSM)对比
总结
在商品化流式的技术更新下,仪器的自动补偿/光谱解析功能已十分智能与易用。按照标准的操作流程制备单染对照并调节补偿/光谱解析,结合科学的多色配色方案,每一个流式操作者都可轻松完成超多色流式分析。更多细节实验流程,欢迎参考以下文献。
参考资料:
1.Sanjabi S, Lear S. New cytometry tools for immune monitoring during cancer immunotherapy. Cytometry B Clin Cytom. 2021. doi: 10.1002/cyto.b.21984.
2.Park LM, Lannigan J, Jaimes MC. OMIP-069: Forty-Color Full Spectrum Flow Cytometry Panel for Deep Immunophenotyping of Major Cell Subsets in Human Peripheral Blood. Cytometry A. 2020. doi: 10.1002/cyto.a.24213.
3.The Right and Wrong Way to Set Up Automated Compensation Tools: How to Achieve Accurate Compensation, https://voices.uchicago.edu/ucflow/2020/06/24/
4.Fox A, Dutt TS, Karger B, Obregón-Henao A, Anderson GB, Henao-Tamayo M. Acquisition of High-Quality Spectral Flow Cytometry Data. Curr Protoc Cytom. 2020. doi: 10.1002/cpcy.74.
5.Ashhurst TM, Smith AL, King NJC. High-Dimensional Fluorescence Cytometry. Curr Protoc Immunol. 2017. doi: 10.1002/cpim.37.






