Cytek Biosciences品牌商
7 年
手机商铺
- NaN
- 0
- 1
- 2
- 1
推荐产品
公司新闻/正文
权威传染病专家福奇教授(Dr. Fauci)团队发表新文献,揭示HIV感染患者或拥有截然不同的长期病毒控制机制
561 人阅读发布时间:2022-02-10 11:25
长期以来寻找更为有效的治疗人类免疫缺陷病毒(human immunodeficiency virus, HIV)感染的方法,是全球相关领域研究者一直致力于的科学事业。许多研究发现,某些HIV感染者在抗逆转录病毒治疗(anti-retroviral therapy, ART)中断的情况下,也能很好控制体内的HIV病毒,深入探索其中潜在的病毒控制和免疫学机制,对于开发全新的HIV治疗方法/策略,将具有非常重要的意义。
享誉全球的传染病专家安东尼·福奇教授(Dr. Anthony S. Fauci),一直站在抗击HIV/AIDS、SARS、2009年猪流感大流行、MERS、埃博拉和COVID-19等病毒性疾病的最前沿。在HIV/AIDS领域,福奇教授一直致力于开发治疗AIDS患者的疗法和免疫重建策略,及用于预防HIV感染的疫苗。他目前的研究主要集中在确定HIV感染的免疫致病机制的性质以及人体对HIV的免疫反应的范围。
前不久,福奇教授及其带领的美国国家过敏和传染病研究所(NIAID)团队在Nature Medicine上发表了一篇题为 “Distinct mechanisms of long-term virologic control in two HIV-infected individuals after treatment interruption of anti-retroviral therapy”*的文章,报道了他们对两名HIV患者的长期跟踪随访结果。该研究利用二代测序和高维流式细胞术等方法,对两名长期控制血浆病毒血症,但在分析治疗中断(analytical treatment interruption, ATI)期间出现不同反弹情况的HIV感染者,进行了深入的病毒学和免疫学分析。

两名受试者(04和30号)均来自于一个前期的随机对照治疗性疫苗试验的安慰剂组,且均在ATI阶段有效控制住血浆病毒血症一段时间,之后发生了病毒反弹。福奇教授团队经过长期(5.6和4年)的跟踪研究发现,两名受试者拥有着截然不同的反弹机制。04号受试者的三次主要反弹,均与其已有的病毒库基因突变累积引起的病毒进化或重新激活有关,而30号受试者在ATI后第1,434天发生的显著反弹,是与该受试者在第1,405天前不久重新暴露于HIV环境所引发的超级感染(superinfection)有关。(图1)
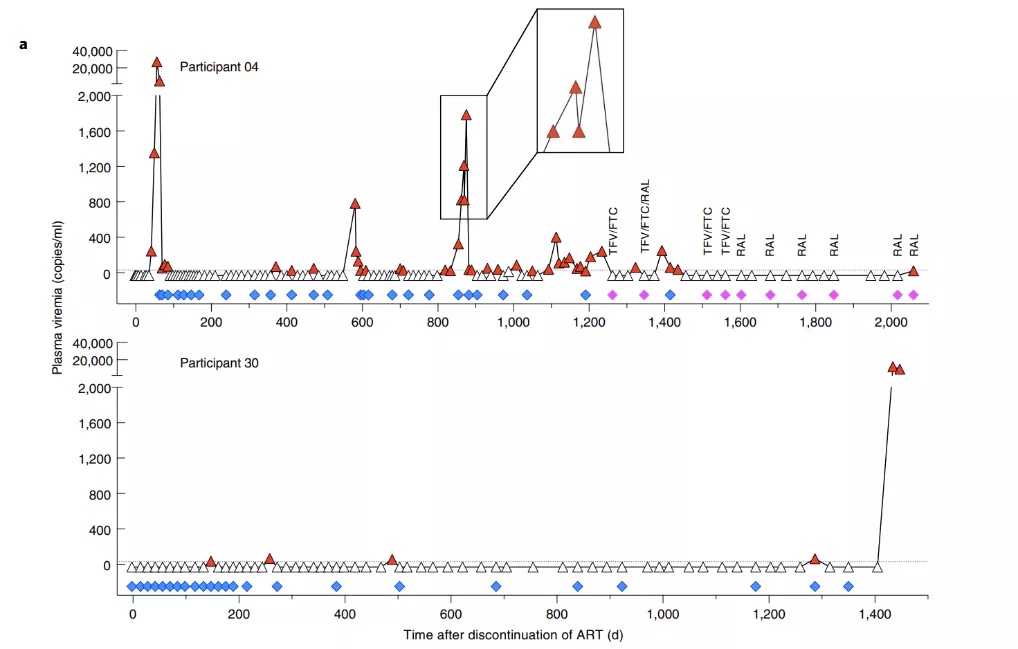
图1. 受试者04号(上)和30号(下)病毒载量随时间的变化趋势
截然不同的病毒反弹情况,提示两名受试者可能存在完全不同的免疫反应机制。利用Cytek® Aurora全光谱流式细胞仪,福奇教授团队通过多色流式细胞术(20色T细胞表型及21色膜&胞内因子检测方案),证实了这一猜想。光谱流式检测方案所使用的试剂详细信息请参考图2。
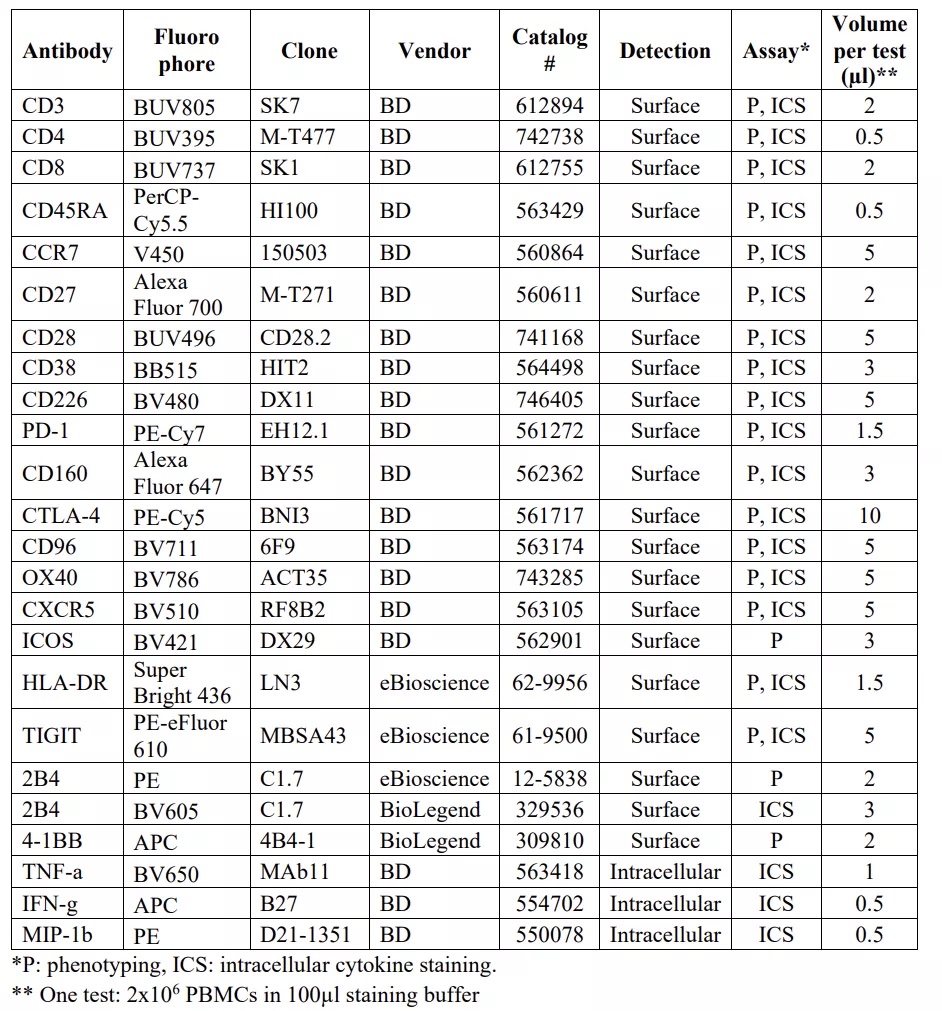
图2. 光谱流式方案的详细试剂信
对20色T细胞表型光谱流式数据进行opt-SNE和FlowSOM分析,全面直观的展示了两名受试者T细胞表型特征的显著差异(图3)。从图3a可以看出,在血浆病毒反弹前,04号受试者 CD8+ T细胞上的TIGIT和HLA-DR/CD38的表达强度和比例始终高于30号受试者。通过观察FlowSOM生成的15个细胞类群,研究者证实了04号受试者有更为活跃的CD8+T细胞反应,伴随免疫激活(HLA-DR/CD38)和衰竭/抑制(TIGIT、2B4、PD-1 和 CD160)等标记的表达升高,其代表过渡/效应记忆(TEM / TTM),或效应记忆重新表达CD45RA(TEMRA)的细胞表型(类群1-3)显著高于30号受试者(图3c-e)。同时04号受试者也表现出更为富集的效应CD4+T细胞(类群7)。相比之下,30号受试者的幼稚 CD4+ T 细胞(类群11) 显著高于04号受试者(图3c-e)。
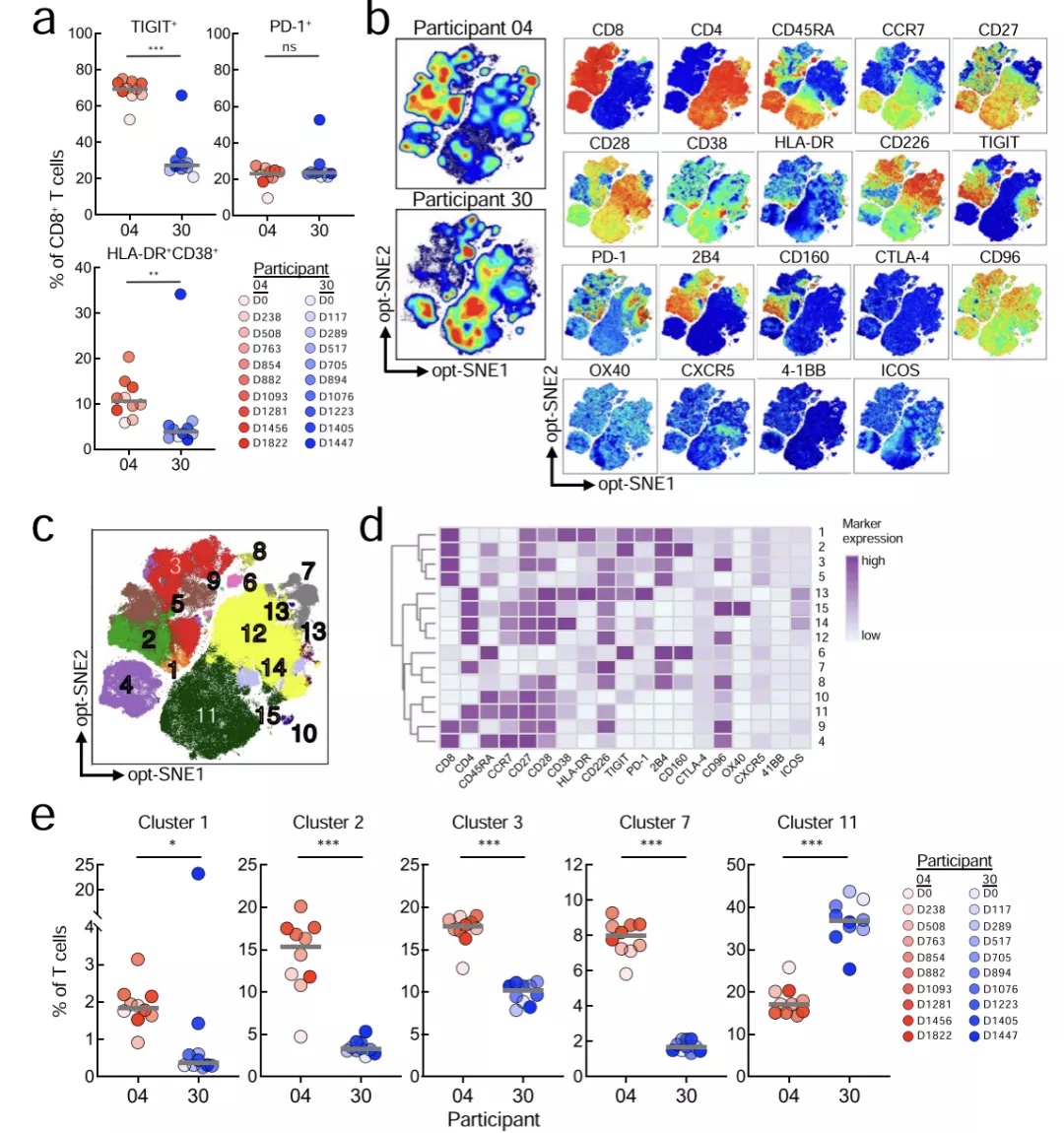
图3. T细胞表型特征分析数据
进一步分析21色膜&胞内因子的光谱流式数据,显示两名受试者在不同的监测时间点,其CD8+T细胞表现出完全不同的表面受体及胞内因子表达模式。从图4 可见,在整个ATI期间,04号受试者的HIV特异性多功能(IFN-γ+TNF-α+MIP-1β+)CD8+T细胞比例显著高于30号受试(图4a),而这些多功能CD8+T细胞在两名受试者中均以效应记忆亚群(TEM、TTM及TEMRA)为主(图4b),尽管如此,04号受试者的TEM亚群比例在任何监测时间点均显著高于其他亚群,而30号受试者仅在某些时间点可以看出TEMRA的比例略高。此外,这些多功能CD8+T细胞的表面受体表达,在两名受试者间也有显著区别(图4c),04号受试者的优势细胞群主要表现为TIGIT+PD-1-CD38lowHLA-DRlow,而30号受试者没有明显的优势群,其CD8+T细胞表现为TIGIT+/-,PD-1lowCD38lowHLA-DRlow (除外病毒反弹时间点)。这些发现揭示,相较于30号受试者,4号受试者拥有更强的CD8+T细胞介导的抗HIV反应,这可能与该受试者持续存在的病毒复制有关。
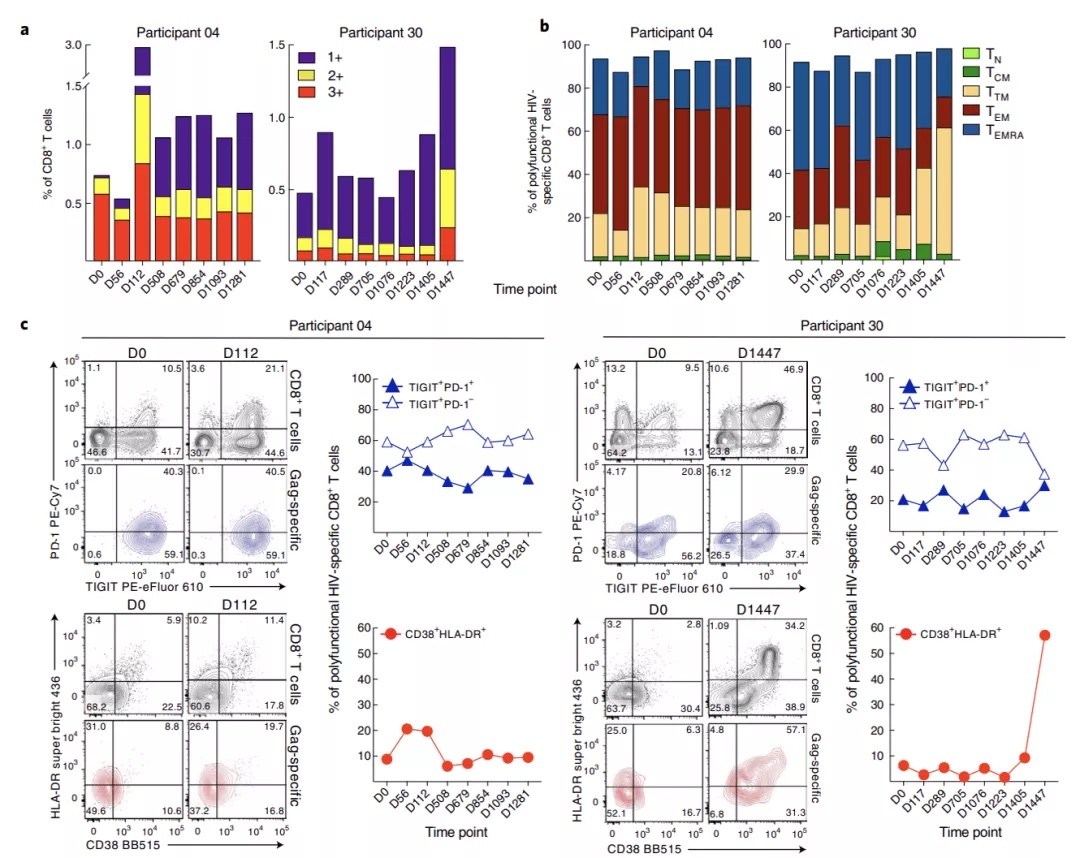
图4. 两名受试者CD8+T细胞功能亚群表面受体及胞内因子呈现出不同的表达模式
综合其他相关研究结果,研究者认为,在ATI阶段,HIV感染者私自用药和超级感染是值得重点关注的问题,而定期全面的病毒学和免疫学监测则显得至关重要。该研究的主要限制,是样本量较小及缺乏ART前的免疫学和病毒学分析,但受益于长期频繁的监测(前3.4年约每2周检测一次),研究者获得了丰富的数据,实时观察到病毒反弹,并鉴定出具有显著差异的免疫和病毒学反应。最后,研究者指出,了解ATI后长期控制HIV的机制范围,及与保护性免疫反应机制的关系,可以为开发新的治疗方法提供有价值的依据。该研究使用Cytek全光谱流式细胞术多色检测方案,全面的跟踪分析了两位受试者的免疫反应机制,为研究的主要实验结论提供了关键的证据。
注:本文仅重点描述了该研究中与光谱流式相关的部分,文章的其他实验结论可参考原文进一步了解。
参考文献
* Blazkova J, Chun TW. Distinct mechanisms of long-term virologic control in two HIV-infected individuals after treatment interruption of anti-retroviral therapy. Nat Med. 2021 Nov;27(11):1893-1898. doi: 10.1038/s41591-021-01503-6.






