Cytek Biosciences品牌商
7 年
手机商铺
- NaN
- 0
- 1
- 2
- 1
推荐产品
公司新闻/正文
IF>20!全光谱流式分选仪携手成像流式细胞仪,演绎T细胞抗真菌全新机制
688 人阅读发布时间:2024-12-16 17:18
辅助性T(TH)细胞通过分泌细胞因子,在抗原特异性免疫反应中扮演着至关重要的角色。其中,TH17细胞通过分泌IL-17,发挥着抵御真菌感染的功能。先天免疫反应可以具备免疫记忆等适应性特征,反之,是否T细胞也可以利用先天免疫信号通路来丰富其效应功能呢?来自德国莱布尼茨天然产物研究和感染生物学研究所的研究团队,首次揭示了TH17细胞通过细胞表面形成 Gasdermin E(GSDME)孔,释放促炎因子IL-1α的全新方式,从而特异性针对白色念珠菌发挥效应功能,相关成果发表于期刊Nature Immunology。
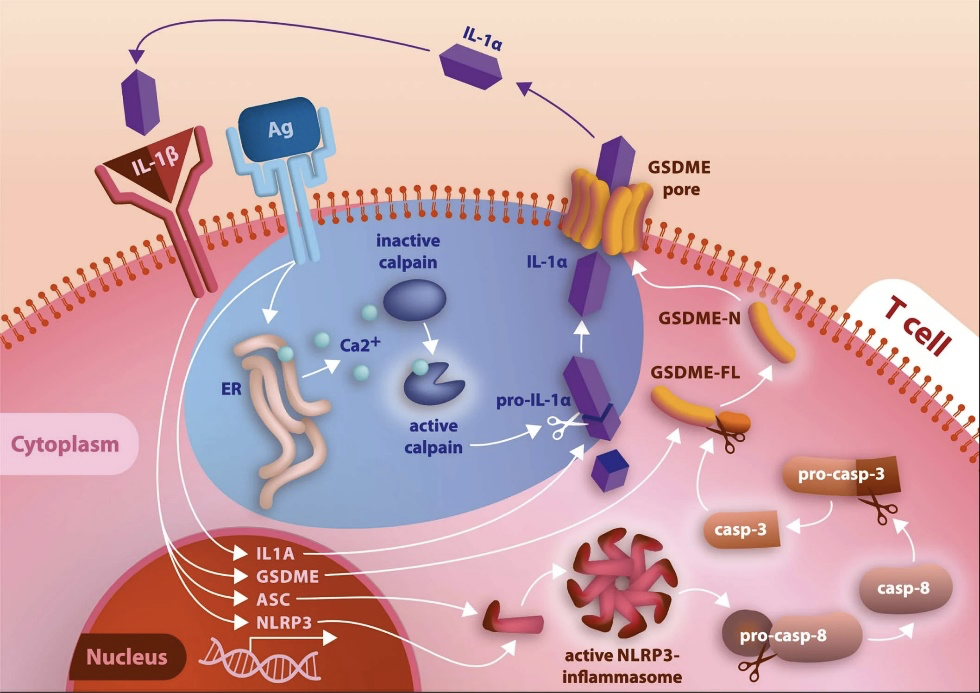
图1 - TH17细胞分泌IL-1α的机制示意图
流式策略
人PBMC通过磁珠法预富集CD4+ T细胞,再使用Cytek® Aurora™ CS全光谱分选型流式细胞仪 同时分选 TH1(CXCR3+CCR4–CCR6–CD45RA–CD25–CD14–)TH2(CXCR3–CCR4+CCR6–CD45RA–CD25–CD14–)TH17(CXCR3–CCR4+CCR6+CD45RA–CD25–CD14–)三群细胞,分选纯度均>98%。细胞经过CD3/CD28抗体刺激后,对接搭载60X物镜的Cytek® Amnis® ImageStream®x MkII成像流式细胞仪,荧光补偿矩阵自动应用于多标管数据。采用系统自带的专业图像分析软件IDEAS® 中的“spot mask”功能,进行ASC和NLRP3荧光点图像参数量化分析。
结果赏析
研究人员采用Aurora™ CS全光谱分选型流式细胞仪分选纯化TH17细胞,CD3/CD28抗体活化刺激后,对接单细胞测序平台作为实验切入点,将TH17细胞细分为6群(图2a),其中Cluster 1中检测到IL-1A的表达(图2b 蓝色点)。流式细胞仪进一步验证了蛋白层面同样存在表达IL-1α的TH17细胞亚群(图2c)。在这一发现之前,IL-1A只被认为是先天免疫细胞发出的危险信号,而并非属于T细胞的典型效应细胞因子库中的一员。相较于健康供者,幼年特发性关节炎患者(图2g,JIA,即一种儿童类风湿性关节炎的高度炎症状态)IL17+ TH17细胞高丰度表达IL-1α,而IFN-γ丰度没有显著性差异。JIA患者的滑膜液(SF)中检测到大量IL-1α+ TH17细胞,进一步表明除了先天免疫细胞,T细胞也可能成为炎症部位与疾病相关的IL-1α的细胞来源。
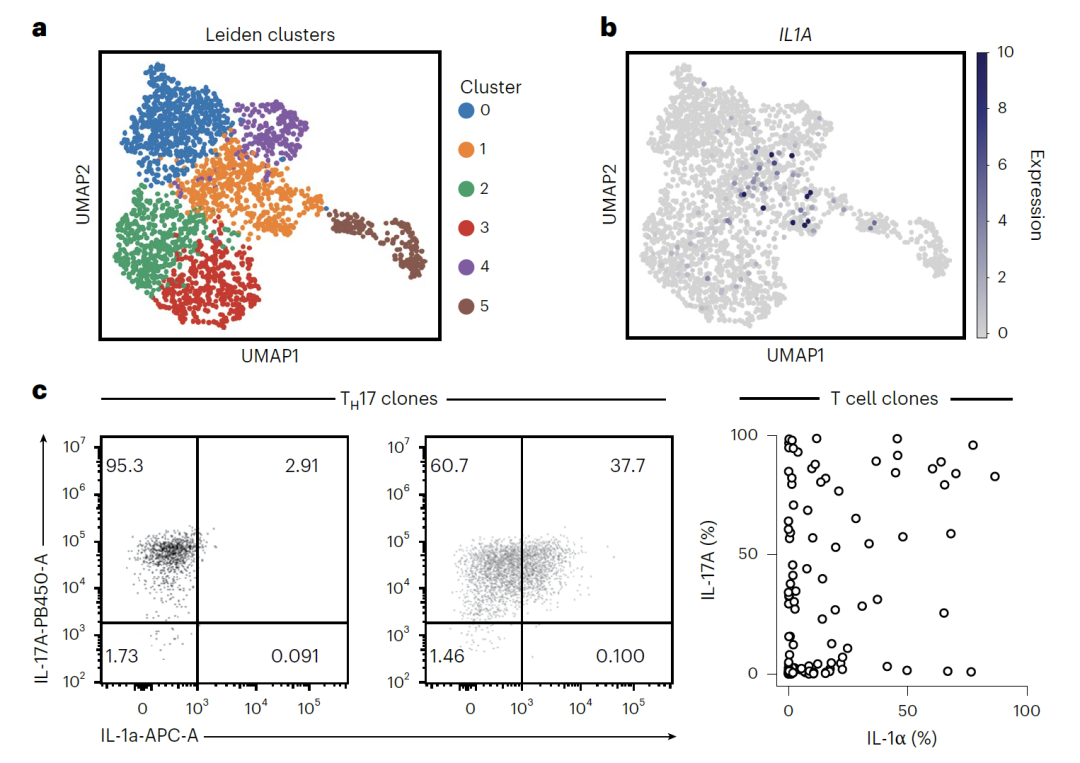
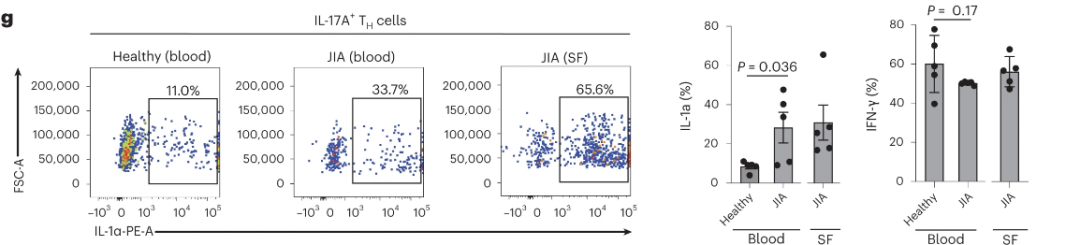
图2 – TH17细胞中存在表达IL-1α的亚群
为了探讨IL-1α表达是否属于T细胞的普遍特性,研究人员通过磁珠法从PBMC中预富集CD4+ TH细胞,接着根据趋化因子受体标志物表达差异,使用Aurora™ CS全光谱分选型流式细胞仪分别分选TH1,TH2,TH17,Treg细胞(图3)。
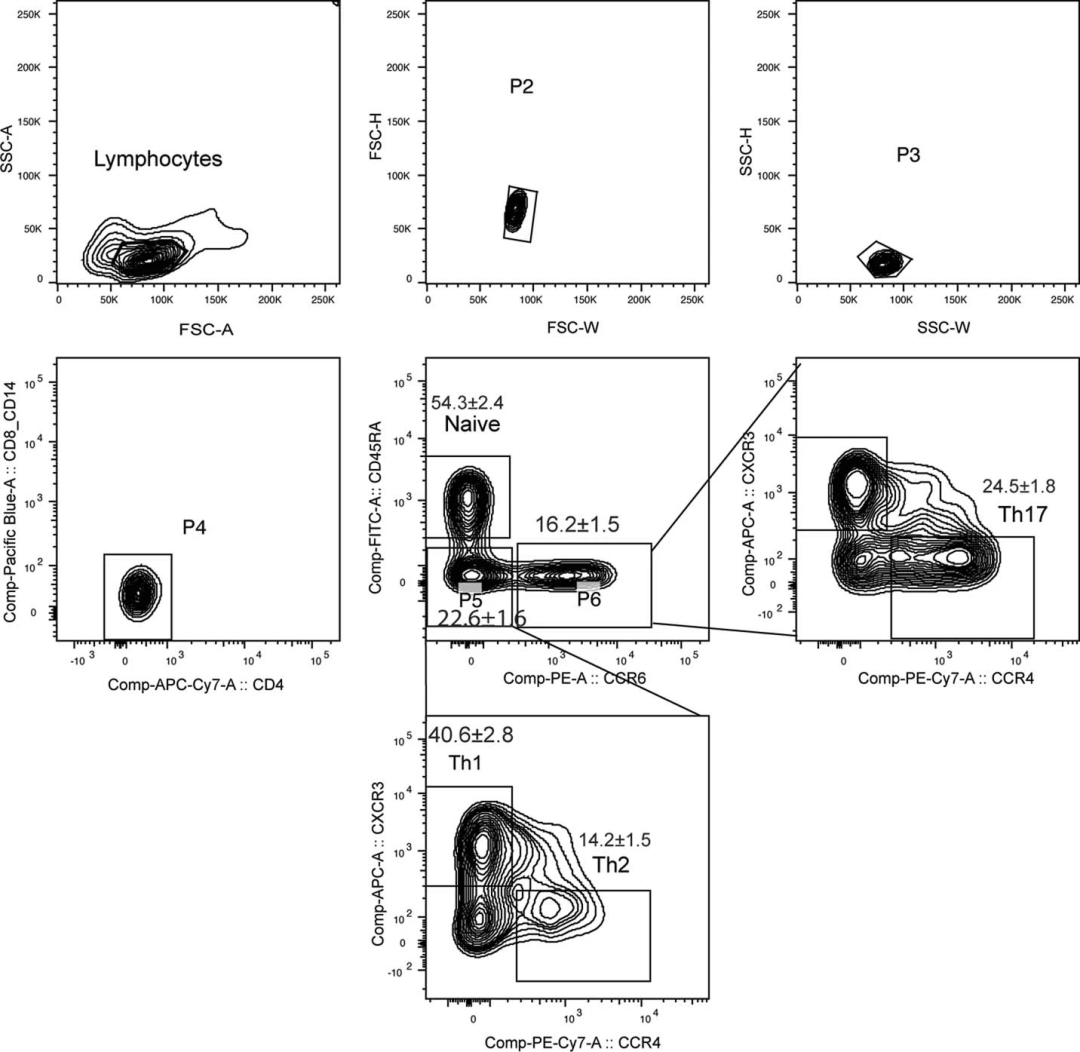
图3 – 全光谱流式分选仪分选人CD4+T细胞亚群门控策略
经过CD3/CD8抗体刺激后,平行对比各群细胞的IL-1α表达丰度差异(图4),发现分泌IL-1α的细胞来源于TH17细胞。
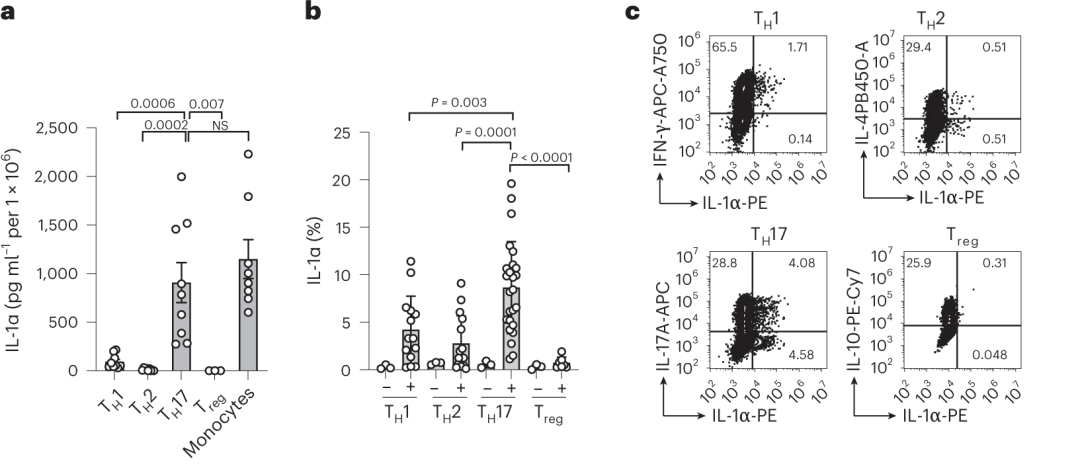
图4 – TH细胞亚群中TH17特异性表达 IL-1α
为了进一步探讨了TH17细胞分泌IL-1α的机制,研究人员使用蛋白输出抑制剂brefeldin A(BFA)处理TH17细胞。与其他传统的细胞因子如IL-17A等不同的是,IL-1α的分泌并未受到影响,这提示了T细胞分泌IL-1α采用不依赖于内质网-高尔基体的非经典的通路。之前有报道表明NLRP3炎症小体在髓系细胞释放IL-1α中起作用,通过Cytek® Amnis® ImageStream®x MkII 成像流式细胞仪高分辨率图像呈现,TH17细胞中NLRP3的衔接分子--含有CARD的细胞凋亡相关斑点状蛋白(ASC)高表达,标志着NLRP3炎症小体处于活化状态(图5a, b)。相较于TH1与TH2细胞,TH17细胞显著性高表达ASC,而加入NLRP3炎症小体特异性抑制剂MCC950后,ASC表达下调(图5b),IL-1α分泌下降(图5d),说明NLRP3炎症小体在调节TH17细胞分泌IL-1α过程中发挥着重要作用。之前已有报道阐明Gasdermins形成细胞膜孔,进而释放炎症介质的方式。TH17细胞也是基于这种方式,通过膜表面形成Gasdermin E(GSDME)孔,释放细胞因子IL-1α(图6)。这种从T细胞输出炎症介质的机制以前从未被报道过。
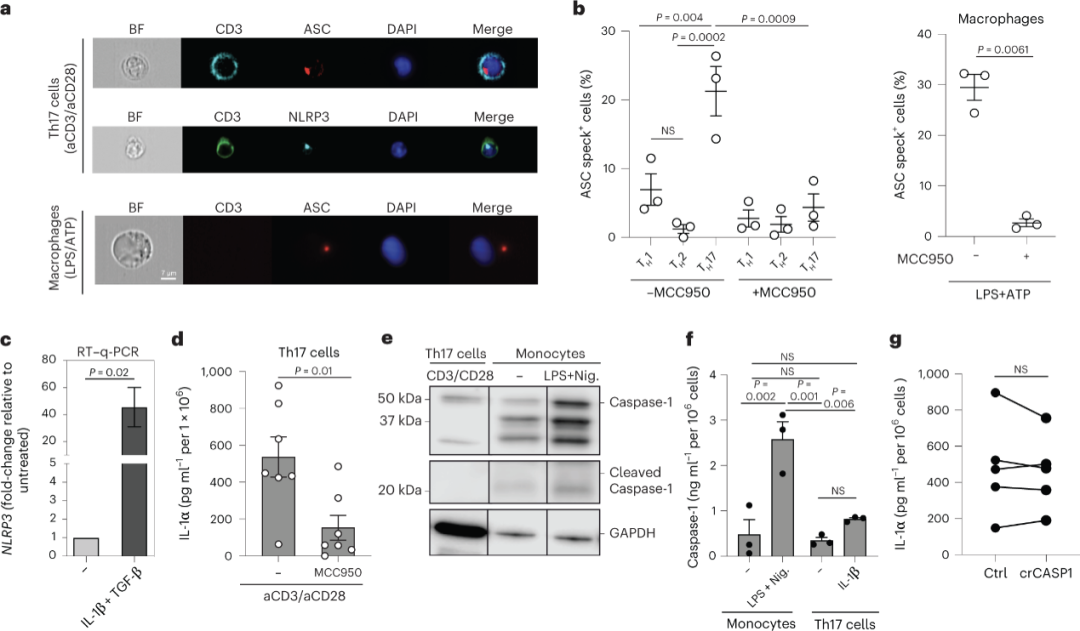
图5 - TH17细胞分泌IL-1α受NLRP3炎症小体的调控
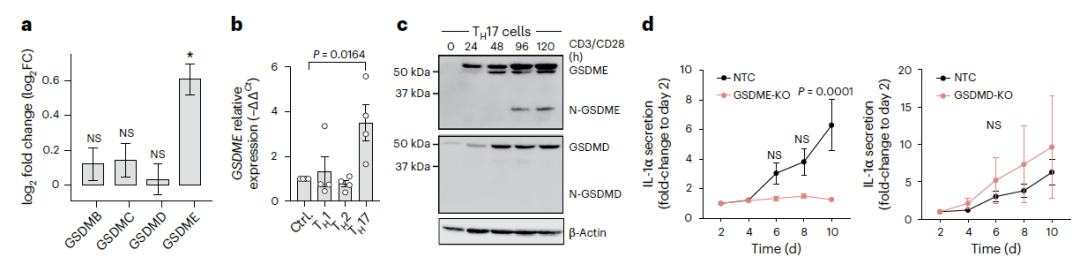
图6 - TH17细胞形成GSDME孔释放IL-1α
TH17细胞释放IL-1α是否具备抗原特异性呢?研究人员发现,白色念珠菌(C. albicans)抗原特异性的TH17细胞,可以大量分泌IL-1α(图7a,b)。经过CD3/CD28抗体刺激的TH17细胞分泌IL-1α,将此TH17细胞上清(包含IL-1α)与单核细胞共培养,流式细胞仪与显微成像结果均呈现出单核细胞对于白色念珠菌的吞噬作用(图7c,d),阐明了TH17细胞通过分泌IL-1α,防御白色念珠菌感染这一全新的机体抗真菌方式。
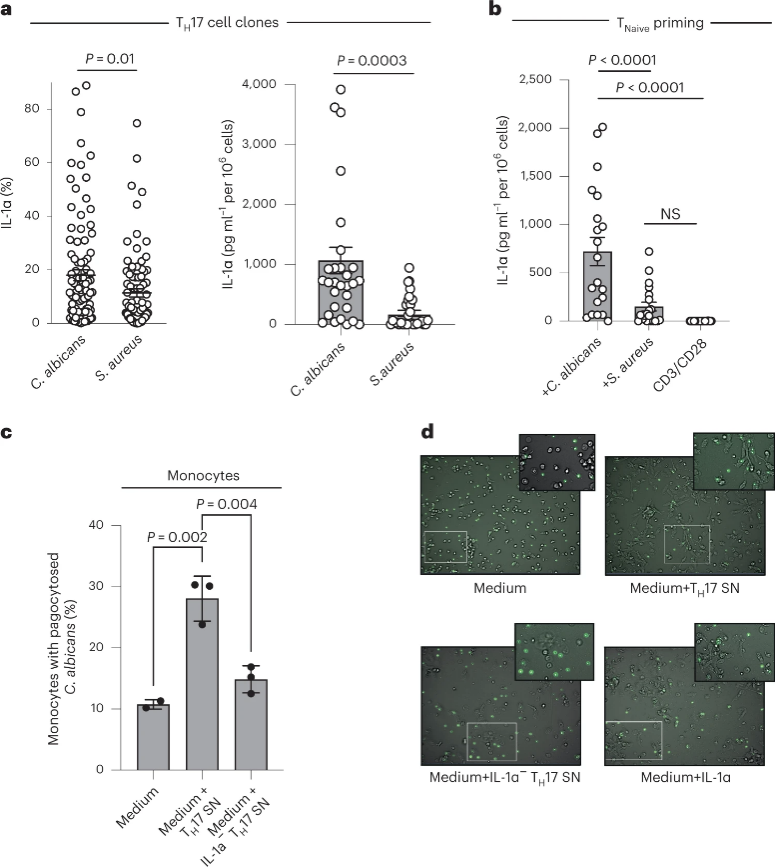
图7 - TH17细胞分泌IL-1α,诱导单核细胞吞噬白色念珠菌
总结展望
研究人员首次发现了TH17细胞在活化状态的NLRP3炎症小体调节下,形成GSDEM膜孔释放IL-1α的全新方式,从而特异性针对白色念珠菌产生免疫反应。这丰富了对于T细胞功能和机制的理解,同时对于抗真菌感染免疫提出了崭新的思路。贯穿全文始终的Cytek®流式系统功不可没,Cytek® Aurora™ CS全光谱分选型流式细胞仪高质量呈现数据,最高支持6路分选,高纯度分选不同的TH细胞亚群,对接Cytek® Amnis® ImageStream®x MkII成像流式细胞仪,采用系统自带的专业图像分析软件,精准量化TH细胞中的荧光斑点图像参数。流式双平台系统演绎高性能,开拓了单细胞层面更高维度的视野。

参考文献
Chao, Y. Y. et al. Human T(H)17 cells engage gasdermin E pores to release IL-1α on NLRP3 inflammasome activation. Nature immunology 24, 295-308, doi:10.1038/s41590-022-01386-w (2023).






