Cytek Biosciences品牌商
7 年
手机商铺
- NaN
- 0
- 1
- 2
- 1
推荐产品
公司新闻/正文
硬核流式操作指南:全光谱流式精细化分析小鼠“大脑卫士”--小胶质细胞
939 人阅读发布时间:2025-03-17 15:51
实验背景
小胶质细胞是大脑中免疫细胞的主角,扮演着碎片吞噬、神经元支持和突触修剪等重要功能,与阿尔兹海默病(AD)等神经系统疾病的发生息息相关。小胶质细胞的不同亚群在神经系统微环境中各司其职,虽然使用荧光显微镜可以对其表型进行区分,但是存在耗时长、通量低、主观性强等局限性;通过单细胞测序平台可以实现高维分析,但是成本高、数据分析技术门槛较高,也限制了该应用的普及。来自美国俄克拉荷马大学健康科学中心的研究人员,基于Cytek® Aurora™全光谱分析型流式细胞仪,建立了高通量、简便易用且实现小胶质细胞精细化分型的完整解决方案。这一方案可以扩展加入更多标志物,也可以延伸应用到不同的组织、疾病类型,还可以无缝衔接全光谱分选型流式细胞仪,分选感兴趣的细胞并对接下游功能性实验。
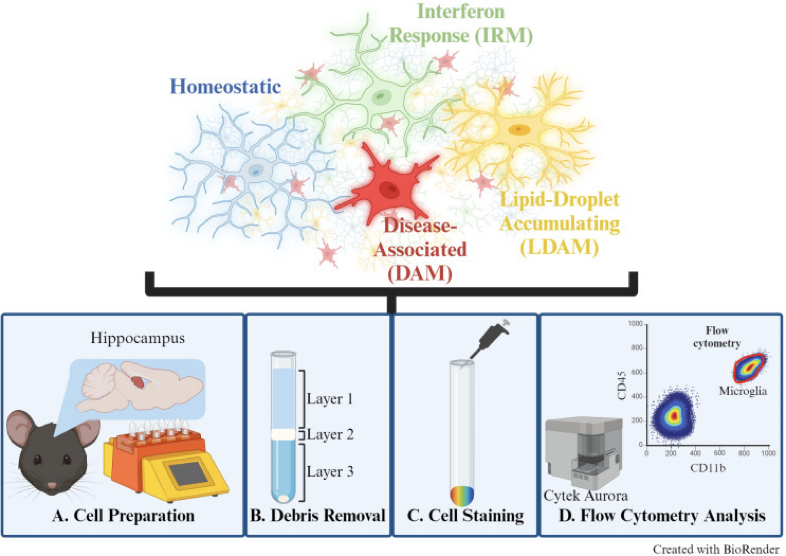
图1 – 全光谱流式细胞仪检测小胶质细胞完整流程1
制备单细胞悬液
1
配置组织消化酶:Enzyme Mix 1: Buffer Z (1,900 μL/样品) + Enzyme P (50 μL/样品);Enzyme Mix 2: Buffer Y (20 μL/样品) + Enzyme A (100 μL/样品)。
2
将1,950 μL Enzyme Mix 1加入到gentleMACS C 管中,并补充2 μL转录和翻译抑制剂,防止小胶质细胞体外活化。
3
冰上解剖分离小鼠海马体,分为4份,放入gentleMACS C 管中,每管中加入30 μL Enzyme Mix 2。
4
将C管放置在组织处理仪器上(美天旎),确保组织全部浸没在缓冲液中,选择程序37C_ABDK_02。
5
程序结束后,取下C管,使用提前冷却到4 ℃的离心机300 g速离,弃上清,D-PBS重悬后,70 μm MACS SmartStrainer 筛网过滤,转移到15 mL离心管中。
6
300 g 4 ℃离心10 min,弃上清,用1,550 μL D-PBS重悬,并转移到5 mL流式管中。
7
加入450 μL Debris Removal Solution,用移液器轻柔吹吸,充分混匀,再缓慢加入2 mL D-PBS覆盖层,注意各层之间不相混合。
8
3000 g 4 ℃离心10 min,流式管中缓冲液会分成3层,吸走第1和2层。
9
用D-PBS将体积补到5mL,盖紧盖子后,颠倒3次充分混匀。1000 g 4 ℃离心10 min,弃上清。
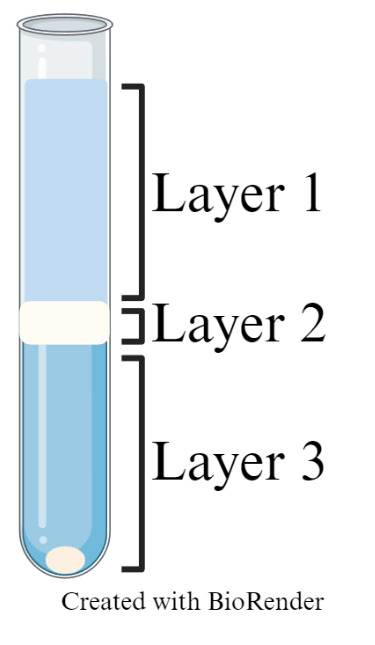
图2 – Layer 1:缓冲液,Layer 2:细胞碎片,
Layer 3:细胞沉淀和缓冲液
细胞染色
1
取1 mL染色缓冲液重悬细胞,吸取100 μL细胞悬液,过滤到新的流式管中。
2
300 g 4 ℃离心10 min,弃上清,残留大约30 μL缓冲液。取50 μL Fc 受体阻断剂(1:200稀释,1 μL TruStain FcX + 199 μL 染色缓冲液)重悬细胞,室温避光孵育5 min。
3
每管用20 μL染色缓冲液重悬至终体积为100 μL。
4
单标管和多标管分别加入对应的抗体,4 ℃避光孵育30 min。
5
使用1 mL染色缓冲液清洗,300 g,4 ℃离心10 min。
6
弃上清,250 μL缓冲液重悬细胞,上机检测。
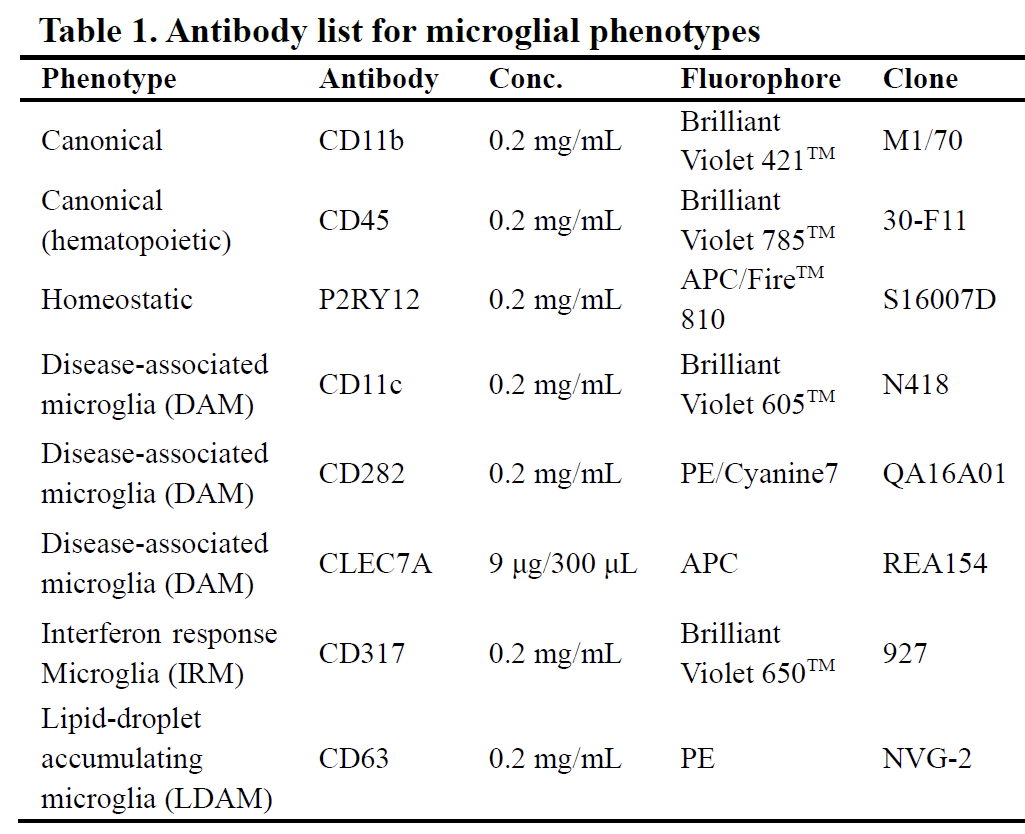
图3 – 小胶质细胞全光谱流式细胞术方案
样本采集及数据分析
1.采用5激光Cytek® Aurora™全光谱分析型流式细胞仪采集样本并分析数据,由于小鼠大脑组织自发荧光很高,数据分析时需要在软件中勾选提取自发荧光的功能。
2.采用FSC/SSC排除碎片,圈选目的细胞,FSC-A/FSC-H排除黏连体干扰,从AF-群体中,基于经典指标CD11b+CD45Mid识别出小胶质细胞。
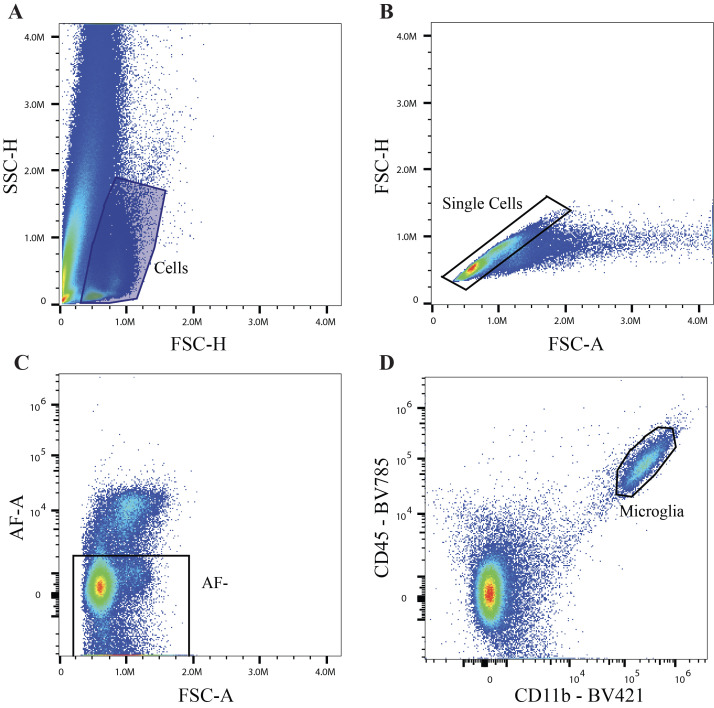
图4 - 小胶质细胞门控策略
3.根据标志物的表达情况,可以将小胶质细胞细分为以下四群:
稳态小胶质细胞(P2RY12+CLEC7A-)
疾病相关小胶质细胞DAM(CD11chighCLEC7Ahigh和/或CD282+CLEC7Ahigh)
干扰素反应性小胶质细胞IRM(CD371+)
脂滴聚集的小胶质细胞LDAM(CD63+)
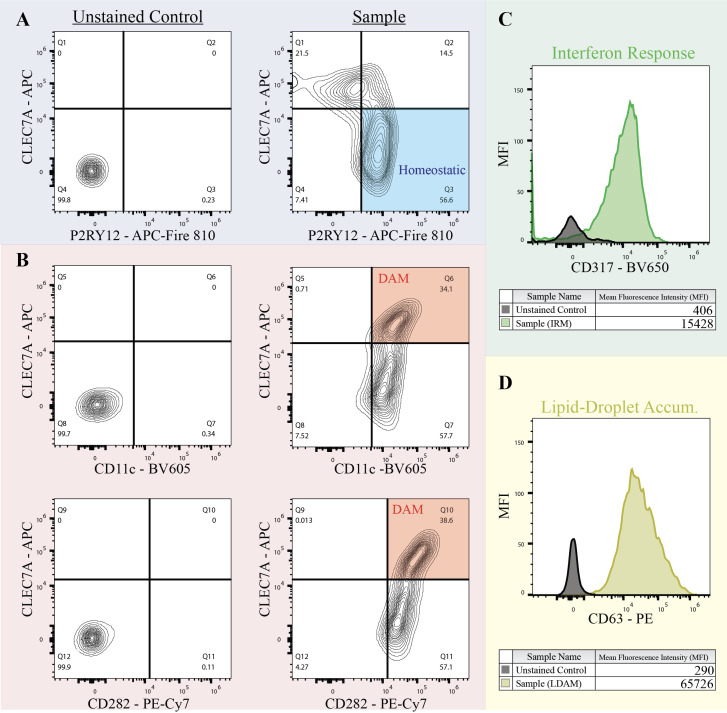
图5 – 小胶质细胞细分为四群
方案重现
在另一篇文章中,这一实验方案得到了重现2。研究人员发现,不同年龄与性别的小鼠海马体中的小胶质细胞存在丰度差异,其中,DAM的比例在年老雌性小鼠中显著性升高(图6F),稳态小胶质细胞比例与年龄关系不大,但是年老雄性小鼠比年老雌性小鼠比例更高(图6G),IRM比例受小鼠年龄影响较大(图6H),LDAM跟DAM情况类似,在年老雌性小鼠中比例更高(图6I)。在衰老小鼠的海马体中,雌性小鼠的小胶质细胞呈现出疾病相关与衰老的表型,这个现象解释了在神经性疾病--阿尔兹海默症患者中,疾病易感性和疾病进展存在性别差异,其背后可能存在的免疫证据。
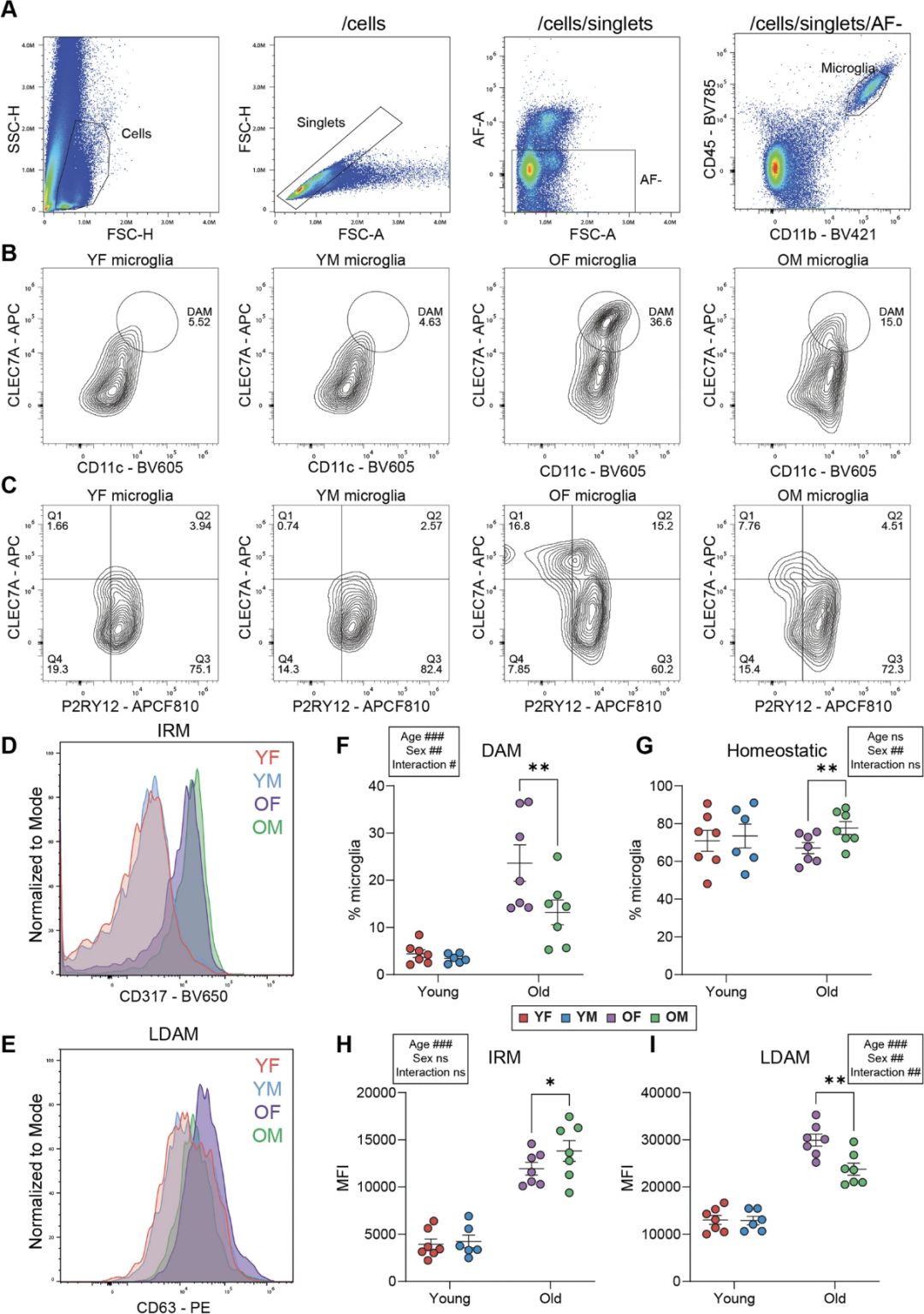
图6 – 不同年龄与性别小鼠的小胶质细胞的丰度差异
参考文献
1Cox, J. E. J. et al. Flow Cytometry Analysis of Microglial Phenotypes in the Murine Brain During Aging and Disease. Bio Protoc 14, e5018, doi:10.21769/BioProtoc.5018 (2024).
2Ocañas, S. R. et al. Microglial senescence contributes to female-biased neuroinflammation in the aging mouse hippocampus: implications for Alzheimer's disease. Journal of neuroinflammation 20, 188, doi:10.1186/s12974-023-02870-2 (2023).






